
 将钠、铝混合物共1.0g投入适量水中充分反应,并测生成H2的量,若混合物中钠与铝的物质的量之比为x,如图为生成H2的物质的量随x的变化关系示意图(随着x的不断增大,产生H2的物质的量越来越接近b1).以下判断不正确的是( )
将钠、铝混合物共1.0g投入适量水中充分反应,并测生成H2的量,若混合物中钠与铝的物质的量之比为x,如图为生成H2的物质的量随x的变化关系示意图(随着x的不断增大,产生H2的物质的量越来越接近b1).以下判断不正确的是( )A、a1=
| ||
| B、a2=1 | ||
C、b1=
| ||
D、b2=
|
| 1 |
| 23 |
| 1 |
| 2 |
| 1 |
| 46 |
| 1 |
| 46 |
| 1 |
| 92 |
1.0g-
| ||
| 27g/mol |
| 1 |
| 36 |
| 1 |
| 92 |
| 1 |
| 36 |
| 9 |
| 23 |
| 1 |
| 23 |
| 1 |
| 2 |
| 1 |
| 46 |
| 1 |
| 2 |
| 3 |
| 2 |
| 1 |
| 25 |


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
 ,工业上合成M线路如下(反应中生成的小分子已略去):
,工业上合成M线路如下(反应中生成的小分子已略去):
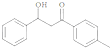 的同分异构体有许多.能与NaHCO3反应,且含有联苯基(
的同分异构体有许多.能与NaHCO3反应,且含有联苯基( 上1个氢原子被取代)的同分异构体共有
上1个氢原子被取代)的同分异构体共有查看答案和解析>>
科目:高中化学 来源: 题型:
| 物质 | 组成和结构信息 |
| a | 由两种元素组成含有A的离子化合物 |
| b | 由两种元素组成含有非极性共价键的离子化合物,且原子数之比为1:1 |
| c | 化学组成为BDF2 |
| d | 只存在一种类型作用力且可导电的单质晶体 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 在密闭容器中,5mol H2与2mol CO2发生反应:3H2(g)十CO2(g)≒CH3OH(g)+H2O(g)反应达到平衡时,改变温度(T)和压强(P),反应混合物中甲醇(CH3OH)的物质的量分数变化情况如图所示下列说法错误的是( )
在密闭容器中,5mol H2与2mol CO2发生反应:3H2(g)十CO2(g)≒CH3OH(g)+H2O(g)反应达到平衡时,改变温度(T)和压强(P),反应混合物中甲醇(CH3OH)的物质的量分数变化情况如图所示下列说法错误的是( )| A、P1>P2>P3>P4 |
| B、甲醇的物质的量分数越高,反应的平衡常数越大 |
| C、若T1>T2>T3>T4,则该反应为放热反应 |
| D、T4、P4时,H2的平衡转化率为60% |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、地沟油的主要成分是高级脂肪酸甘油酷,可用于制肥皂和加工食用油 |
| B、棉、麻、丝、毛及合成纤维完全燃烧都只生成C02和H20,对环境不会有影响 |
| C、BaSO4在医学上用作钡餐,Ba2+对人体无毒 |
| D、“落汤螃蟹着红袍”肯定发生了化学变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 用如图所示装置进行实验.实验过程中,两极均有气体产生,Y极区溶液逐渐变成紫红色;停止实验,铁电极明显变细,电解液仍然澄清.查阅资料发现,高铁酸根(FeO42-)在溶液中呈紫红色.
用如图所示装置进行实验.实验过程中,两极均有气体产生,Y极区溶液逐渐变成紫红色;停止实验,铁电极明显变细,电解液仍然澄清.查阅资料发现,高铁酸根(FeO42-)在溶液中呈紫红色.查看答案和解析>>
科目:高中化学 来源: 题型:

| 气体 | 氮气 | 氢气 | 氨 |
| 熔点(℃) | -210.01 | -252.77 | -77.74 |
| 沸点(℃) | -195.79 | -259.23 | -33.42 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com