
 某化学兴趣小组采用下列方法测定Na2SO3样品中Na2SO4的质量分数.
某化学兴趣小组采用下列方法测定Na2SO3样品中Na2SO4的质量分数.| m 4g |
| 233g/mol |
| ||
| 2m 4 |


 口算题天天练系列答案
口算题天天练系列答案科目:高中化学 来源: 题型:
 请按下列要求填空
请按下列要求填空查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①② | B、①②③④ |
| C、②③ | D、③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、只要溶液里有H+,溶液就显酸性 |
| B、H+浓度增大,溶液的酸性一定增强 |
| C、c(H+)>c(OH-),溶液一定显酸性 |
| D、强酸溶液的酸性一定比弱酸溶液的酸性强 |
查看答案和解析>>
科目:高中化学 来源: 题型:
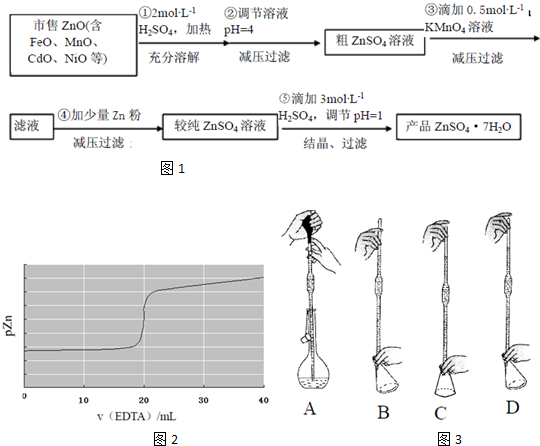
查看答案和解析>>
科目:高中化学 来源: 题型:
 已知Ⅰ.N-N键键能为167kJ?mol-1,N≡N键键能为942kJ?mol-1,
已知Ⅰ.N-N键键能为167kJ?mol-1,N≡N键键能为942kJ?mol-1,| A、+1066.4 kJ?mol-1 |
| B、-1066.4 kJ?mol-1 |
| C、+697.6 kJ?mol-1 |
| D、-697.6 kJ?mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 弱酸 | HCOOH | HCN | H2CO3 |
| 电离平衡常数(25℃) | K1=1.77×10-4 | K1=4.9×10-10 | Ki1=4.3×10-7 Ki2=5.6×10-11 |
| A、中和等体积、等pH的HCOOH和HCN消耗NaOH的量前者小于后者 |
| B、相同温度时,等浓度的HCOONa和NaCN溶液的pH前者小于后者 |
| C、2CN-+H2O+CO2=2HCN+CO32- |
| D、2HCOOH+CO32-=2HCOO-+H2O+CO2↑ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com