
【题目】乙醇分子中不同的化学键如图:关于乙醇在各种反应中断裂键的说法不正确的是

A. 乙醇和钠反应,键①断裂
B. 在铜催化下和O2反应,键①③断裂
C. 浓硫酸作用下加热至170℃时的反应,键②⑤断裂。
D. 浓硫酸作用下加热至140℃时的反应,键①⑤断裂
【答案】D
【解析】
乙醇的官能团为-OH,可发生取代反应、氧化反应和消去反应,可与钠反应,结合官能团的性质判断可能的共价键的断裂方式。
A项、乙醇和钠反应生成乙醇钠和氢气时,羟基上O-H键断裂,即键①断裂,故A正确;
B项、乙醇发生催化氧化生成乙醛时,连接羟基碳原子上的C-H键和羟基中O-H键断裂,即键①和键③断裂,故B正确;
C项、乙醇浓硫酸作用下加热至170℃发生消去反应生成乙烯时,与羟基相连碳原子上的C-O键和与羟基相邻的碳原子上的C-H键断裂,即键②⑤断裂,故C正确;
D项、乙醇浓硫酸作用下加热至140℃发生分子间脱水反应生成乙醚反应时,一个醇分子断氢氧键,另一个醇分子断碳氧键,即①或②断裂,故D错误。
故选D。


 优等生题库系列答案
优等生题库系列答案科目:高中化学 来源: 题型:
【题目】为测定某有机化合物A的结构,进行如下实验:
(一)分子式测定:
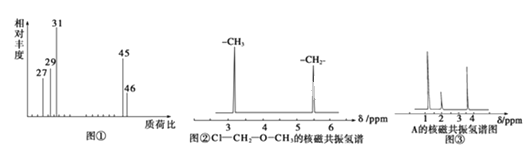
(1)将4.6g有机物A置于氧气流中充分燃烧,实验测得:生成5.4g H2O和8.8g CO2,,则该物质的实验式为_______________;
(2)用质谱仪测定该有机化合物的相对分子质量,得到如图①所示质谱图,则其相对分子质量为____________________;
(3)根据价键理论,预测A的可能结构并写出结构简式___________________________;
(二)结构式的确定:
(4)核磁共振氢谱能对有机物分子中不同化学环境的氢原子给出不同的峰值(信号),根据峰值(信号)可以确定分子中氢原子的种类和数目.例如:甲基氯甲基醚(ClCH2OCH3)有两种氢原子如图②.经测定,有机物A的核磁共振氢谱示意图如图③,则A的结构简式为_____________________________;
(三)性质实验
(5)A在一定条件下脱水可生成B,B可合成包装塑料C,请写出B转化为C的化学反应方程式________________________;
(6)体育比赛中当运动员肌肉扭伤时,队医随即用氯乙烷(沸点为12.27℃)对受伤部位进行局部冷冻麻醉.请用B选择合适的方法制备氯乙烷,要求原子利用率为100%,请写出制备反应方程式_______________;
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某溶液中含有较大量的Cl﹣、![]() 、OH﹣等3种阴离子,如果只取一次该溶液就能够分别将3种阴离子依次检验出来,下列实验操作顺序正确的是( )
、OH﹣等3种阴离子,如果只取一次该溶液就能够分别将3种阴离子依次检验出来,下列实验操作顺序正确的是( )
①滴加Mg(NO3)2溶液;②过滤;③滴加AgNO3溶液;④滴加Ba(NO3)2溶液
A.①②④②③B.④②①②③C.①②③②④D.④②③②①
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】欲提纯混有硫酸钠、碳酸氢铵的氯化钠固体,某学生设计了如下方案:

请根据操作流程回答下列问题:
(1)操作①在加热时应选择___盛装混合物(填仪器名称)。
(2)进行操作②后,判断SO42已沉淀完全的方法是___。
(3)操作③的化学方程式为___。
(4)操作④的目的是___。
(5)实验室进行操作⑤的具体步骤是___。
(6)某同学欲用制得的氯化钠固体配制100mL0.2molL1的氯化钠溶液。
①配制NaCl溶液时需用到的主要仪器有托盘天平、药匙、烧杯、玻璃棒、量筒、__、__。
②下列操作会使所配氯化钠溶液浓度偏小的是___(请填序号)。
A.加水定容时俯视刻度线
B.容量瓶内壁附有水珠而未干燥处理
C.在溶解过程中有少量液体溅出烧杯外
D.颠倒摇匀后发现凹液面低于刻度线又加水补上
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化合物由碳、氢、氧三种元素组成,其红外光谱图有C—H键、H—O键、C—O键的振动吸收,该有机物的相对分子质量是60,则该有机物的结构简式可能是
A. CH3CH2CH2OHB. 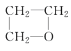 C. CH3CH2OCH3D. CH3CH2CHO
C. CH3CH2OCH3D. CH3CH2CHO
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某超市违规出售的一种鸡蛋为“橡皮蛋”,煮熟后蛋黄韧性胜过乒乓球,但经检测为真鸡蛋。专家介绍,这是由于鸡饲料里添加了棉籽饼,从而使鸡蛋里含有过多棉酚所致。棉酚的结构简式如图所示。下列说法不正确的是
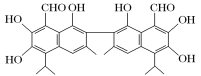
A. 该化合物的分子式为C30H30O8
B. 既能与FeCl3发生显色反应,也能和NaHCO3反应放出CO2
C. 1 mol棉酚最多可与6 mol NaOH反应
D. 该物质可以使酸性高锰酸钾溶液褪色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用化学原理对工厂排放的废水、废渣等进行有效检测与合理处理。
某工厂对制革工业污泥中Cr元素的回收与再利用工艺如图(硫酸浸取液中金属离子主要是Cr3+,其次是Fe3+、Fe2+、Al3+、Ca2+、Mg2+):
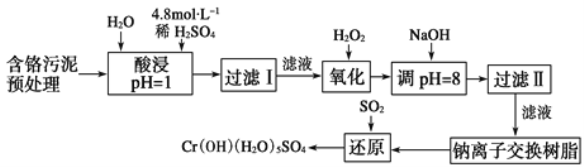
常温下部分阳离子以氢氧化物形式沉淀时溶液的pH见表:
阳离子 | Fe3+ | Fe2+ | Mg2+ | Al3+ | Cr3+ |
开始沉淀时的pH | 1.9 | 7.0 | - | - | - |
沉淀完全时的pH | 3.2 | 9.0 | 11.1 | 8 | 9(>9溶解) |
(1) 酸浸时,为了提高浸取率可采取的措施是____(至少写两条)。
(2)H2O2的作用是_____。
(3)调pH=8是为了除去___(填Fe3+、Fe2+、Al3+、Ca2+、Mg2+)。
(4)钠离子交换树脂的原理为Mn++nNaR→MRn+nNa+,被交换的杂质离子是___(填Fe3+、Fe2+、Al3+、Ca2+、Mg2+)。
(5)已知以下氧化还原反应方程式(未配平):Na2Cr2O7+SO2+H2O=Cr(OH)(H2O)5SO4+Na2SO4;以上反应各物质的配平系数依次为___。每生成1 mol Cr(OH)(H2O)5SO4转移电子的数目为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯水中存在多种分子和离子,它们在不同的反应中表现各自的性质。下列实验现象和结论一致且正确的是( )
A. 加入有色布条,一会儿有色布条退色,说明有Cl2存在
B. 溶液呈黄绿色,且有刺激性气味,说明有HClO分子存在
C. 先加入硝酸酸化,再加入AgNO3溶液产生白色沉淀,说明有Cl-存在
D. 加入NaOH溶液,氯水黄绿色消失,说明有HClO分子存在
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关表述正确的是 ( )
A. 醋酸的电离方程式:CH3COOH=CH3COO-+H+
B. Na与水反应的离子方程式:2Na+2H2O=2Na++2OH-+H2↑
C. NaHCO3的电离方程式:NaHCO3=Na++H++CO32-
D. Cu溶于稀HNO3的离子方程式:Cu+2H+=Cu2++H2↑
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com