
| ||
| (m-m1)g |
| mg |
| 100(m-m1) |
| mg |
(m2g×
| ||
| mg |
100(m2×
| ||
| m |
| 174 |
| 233 |
| 149 |
| 233 |
| 238 |
| 149 |
100(m1-
| ||||
| m |
| 100(m-m1) |
| mg |
100(m2×
| ||
| m |
100(m1-
| ||||
| m |


科目:高中化学 来源: 题型:阅读理解
2- 4 |

2- 4 |
2- 4 |
2- 4 |
2- 4 |
2- 4 |
2- 4 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
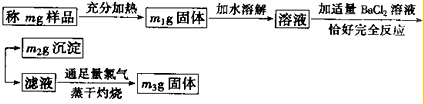
实验室里需要纯净的氯化钠溶液,但现有的氯化钠晶体中混有少量硫酸钠和碳酸氢铵,设计一组实验去杂质。试简单回答下列问题。
(1)除去碳酸氢铵,用加热方法好,还是加入强碱微热的方法好?
答:______________,原因是____________________,判断碳酸氢铵已完全除去的方法是__________________________。
(2)加热的固体残渣溶于水后,应该用氯化钡溶液还是硝酸钡溶液除去SO42-?
答:_____________,原因是______________,判断SO42-已完全除去的方法是_________。
查看答案和解析>>
科目:高中化学 来源:鲁版必修1第03章第3节 硫的转化 题型:实验题
实验室里需要纯净的氯化钠溶液,但现有的氯化钠晶体中混有少量硫酸钠和碳酸氢铵,设计一组实验去杂质。试简单回答下列问题。
(1)除去碳酸氢铵,用加热方法好,还是加入强碱微热的方法好?
答:______________,原因是____________________,判断碳酸氢铵已完全除去的方法是__________________________。
(2)加热的固体残渣溶于水后,应该用氯化钡溶液还是硝酸钡溶液除去SO42-?
答:_____________,原因是______________,判断SO42-已完全除去的方法是_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
工业制备氯化铜时,常将浓盐酸用蒸汽加热到80℃左右,慢慢加入粗CuO粉末(含有杂质![]() 、
、![]() )充分反映,使之溶解,得到强酸性的混合溶液,欲从该混合溶液中制备纯净的
)充分反映,使之溶解,得到强酸性的混合溶液,欲从该混合溶液中制备纯净的![]() 溶液。请参照下表给出的数据回答下列问题:
溶液。请参照下表给出的数据回答下列问题:
| 部分金属阳离子 |
|
|
|
| 以氢氧化物形式沉淀完全是的pH | ≥9.6 | ≥3.7 | ≥6.4 |
(1)第一步除去![]() ,能否直接调整pH=9.6将
,能否直接调整pH=9.6将![]() 转化为沉淀出去 (填“能”或“否”);理由是 。
转化为沉淀出去 (填“能”或“否”);理由是 。
若用强氧化剂![]() 将
将![]() 氧化为
氧化为![]() ,则加入
,则加入![]() 后,溶液的pH的变化是 。
后,溶液的pH的变化是 。
A.一定增大 B.一定减小 C.可能增大 D.可能减小
(2)除去溶液中的![]() 的方法是调整溶液的pH=3.7,现有下列试剂均可使强酸性溶液的pH调整到3.7,可选用的有 。
的方法是调整溶液的pH=3.7,现有下列试剂均可使强酸性溶液的pH调整到3.7,可选用的有 。
A.![]() B.氨水 C.
B.氨水 C.![]() D.
D.![]() E.
E.![]() F.
F.![]()
(3)亚铁盐在溶液中易被氧化,而实验室中需要纯净的亚铁盐溶液,那么保存亚铁盐溶液时应该如何防止亚铁盐氧化?
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com