
【题目】甲是一种可用于净水和膨化食品的盐,由A、B、C、D、E五种短周期元素组成.甲溶于水后可电离出三种离子,其中一种是由A、B形成的10电子阳离子.A元素原子核内质子数比E的少l,D、E同主族.某同学为探究甲的组成而进行如下实验: ①取mg甲的晶体溶于蒸馏水,配成500mL溶液;
②取少量甲溶液于试管中,逐滴滴入Ba(OH)2溶液,生成沉淀的物质的量与滴入Ba(OH)2溶液体积的关系如图所示;
③取20mL甲溶液于试管中,加入过量NaOH溶液后加热并收集产生的气体,然后折算成标准状况下的体积为224mL.
回答下列问题:
(1)D在元素周期表中的位置为 .
(2)经测定晶体甲的摩尔质量为453gmol﹣1 , 其中阳离子和阴离子物质的量之比为1:1. 则晶体甲的化学式为 .
(3)图象中V(Oa):V(ab):V(bc)= .
(4)写出ab段发生反应的离子方程式: .
(5)配成的甲溶液物质的量浓度是 .
【答案】
(1)第三周期VIA族
(2)NH4Al(SO4)2?12H2O
(3)3:1:1
(4)2NH4++SO42﹣+Ba2++2OH﹣=BaSO4↓+2NH3 . H2O
(5)0.5mol?L﹣1
【解析】解:甲由A、B、C、D、E五种短周期元素组成的一种盐,②取少量甲溶液于试管中,逐滴滴入Ba(OH)2溶液,生成沉淀开始增大,后沉淀减小,但沉淀最终不完全消失,则甲溶液肯定含有SO42﹣、Al3+ , ③取20mL甲溶液于试管中,加入过量NaOH溶液后加热并收集产生的气体,则甲溶液中含有NH4+ , 甲溶于电离处于三种离子,A、B形成的10电子阳离子为NH4+ , D、E同主族,二者应形成SO42﹣ , 且A元素原子核内质子数比E的少l,则A为N元素、E为O元素、D为S元素、B为H元素、C为Al.(2)中经测定晶体甲的摩尔质量为453g.mol﹣1 , 且1mol甲晶体中含有12mol结晶水,所以阳离子和阴离子的分子量为:453﹣216=237,阳离子和阴离子物质的量之比1:1,根据电中性原理,其化学式为:NH4Al(SO4)212H2O.oa段发生反应:2NH4Al(SO4)2+3Ba(OH)2=3BaSO4↓+2Al(OH)3↓+(NH4)2SO4 , ab段发生反应:(NH4)2SO4+Ba(OH)2=BaSO4↓+2NH3 . H2O,bc段发生反应:OH﹣+Al(OH)3=AlO2﹣+2H2O.(1)D为S元素,处于周期表中第三周期VIA族,故答案为:第三周期VIA族;(2)由上述分析可知,甲的化学式为:NH4Al(SO4)212H2O,故答案为:NH4Al(SO4)212H2O;(3)假设NH4Al(SO4)212H2O为2mol,oa段发生反应:2NH4Al(SO4)2+3Ba(OH)2=3BaSO4↓+2Al(OH)3↓+(NH4)2SO4 , 消耗3molBa(OH)2 , 生成1mol(NH4)2SO4 , 生成2molAl(OH)3 , ab段发生反应:(NH4)2SO4+Ba(OH)2=BaSO4↓+2NH3 . H2O,1mol(NH4)2SO4消耗1molBa(OH)2 , bc段发生反应:OH﹣+Al(OH)3=AlO2﹣+2H2O,2molAl(OH)3消耗1molBa(OH)2 , 故图象中V(Oa):V(ab):V(bc)=3mol:1mol:1mol=3:1:1,故答案为:3:1:1;(4)ab段发生反应:(NH4)2SO4+Ba(OH)2=BaSO4↓+2NH3 . H2O,离子方程式为:2NH4++SO42﹣+Ba2++2OH﹣=BaSO4↓+2NH3 . H2O,故答案为:2NH4++SO42﹣+Ba2++2OH﹣=BaSO4↓+2NH3 . H2O;(5)实验③中取20mL甲溶液于试管中,加入过量NaOH溶液后加热并收集产生的氨气为 ![]() =0.01mol,则NH4Al(SO4)2为0.01mol,故溶液浓度为
=0.01mol,则NH4Al(SO4)2为0.01mol,故溶液浓度为 ![]() =0.5mol/L,故答案为:0.5mol/L. 甲由A、B、C、D、E五种短周期元素组成的一种盐,②取少量甲溶液于试管中,逐滴滴入Ba(OH)2溶液,生成沉淀开始增大,后沉淀减小,但沉淀最终不完全消失,则甲溶液肯定含有SO42﹣、Al3+ , ③取20mL甲溶液于试管中,加入过量NaOH溶液后加热并收集产生的气体,则甲溶液中含有NH4+ , 甲溶于电离处于三种离子,A、B形成的10电子阳离子为NH4+ , D、E同主族,二者应形成SO42﹣ , 且A元素原子核内质子数比E的少l,则A为N元素、E为O元素、D为S元素、B为H元素、C为Al.(2)中经测定晶体甲的摩尔质量为453g.mol﹣1 , 且1mol甲晶体中含有12mol结晶水,所以阳离子和阴离子的分子量为:453﹣216=237,阳离子和阴离子物质的量之比1:1,根据电中性原理,其化学式为:NH4Al(SO4)212H2O,oa段发生反应:2NH4Al(SO4)2+3Ba(OH)2=3BaSO4↓+2Al(OH)3↓+(NH4)2SO4 , ab段发生反应:(NH4)2SO4+Ba(OH)2=BaSO4↓+2NH3 . H2O,bc段发生反应:OH﹣+Al(OH)3=AlO2﹣+2H2O,据此解答.
=0.5mol/L,故答案为:0.5mol/L. 甲由A、B、C、D、E五种短周期元素组成的一种盐,②取少量甲溶液于试管中,逐滴滴入Ba(OH)2溶液,生成沉淀开始增大,后沉淀减小,但沉淀最终不完全消失,则甲溶液肯定含有SO42﹣、Al3+ , ③取20mL甲溶液于试管中,加入过量NaOH溶液后加热并收集产生的气体,则甲溶液中含有NH4+ , 甲溶于电离处于三种离子,A、B形成的10电子阳离子为NH4+ , D、E同主族,二者应形成SO42﹣ , 且A元素原子核内质子数比E的少l,则A为N元素、E为O元素、D为S元素、B为H元素、C为Al.(2)中经测定晶体甲的摩尔质量为453g.mol﹣1 , 且1mol甲晶体中含有12mol结晶水,所以阳离子和阴离子的分子量为:453﹣216=237,阳离子和阴离子物质的量之比1:1,根据电中性原理,其化学式为:NH4Al(SO4)212H2O,oa段发生反应:2NH4Al(SO4)2+3Ba(OH)2=3BaSO4↓+2Al(OH)3↓+(NH4)2SO4 , ab段发生反应:(NH4)2SO4+Ba(OH)2=BaSO4↓+2NH3 . H2O,bc段发生反应:OH﹣+Al(OH)3=AlO2﹣+2H2O,据此解答.


科目:高中化学 来源: 题型:
【题目】一定量的CuS和Cu2S的混合物投入足量的HNO3中,收集到气体V L(标准状况),向反应后的溶液中(存在Cu2+和SO42﹣)加入足量NaOH,产生蓝色沉淀,过滤,洗涤,灼烧,得到CuO 12.0g,若上述气体为NO和NO2的混合物,且体积比为1:1,则V可能为( )
A.9.0 L
B.13.5 L
C.15.7 L
D.16.8 L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知反应mX(g)+nY(g)qZ(g)的△H<0,m+n>q,在恒容密闭容器中反应达到平衡时,下列说法正确的是( )
A.通入稀有气体使压强增大,平衡将正向移动
B.X的正反应速率是Y的逆反应速率的 ![]() 倍
倍
C.降低温度,混合气体的平均相对分子质量变小
D.增加X的物质的量,Y的转化率降低
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲、乙两种单质,A、B、C、D、E、F六种化合物之间可以按下面框图进行反应, 已知:C为红褐色沉淀,E为白色沉淀,F焰色反应为黄色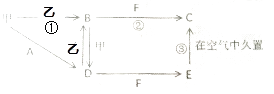
(1)写出甲、乙、B、E化学式: 甲:乙:B:E:
(2)写出①②③反应化学方程式: ①
②
③ .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】周期表前四周期的元素a、b、c、d、e,原子序数依次增大.A的核外电子总数与其电子层数相同,b的价电子层中的未成对电子有3个,c的最外层电子数为其内层电子数的3倍,d与c同主族,e的最外层只有1个电子,但次外层有18个电子.回答下列问题:
(1)b、c、d中第一电离能最大的是(填元素符号),e的价层电子轨道示意图为 .
(2)a和其他元素形成的二元共价化合物中,分子呈三角锥形,该分子的中心原子的杂化方式为;分子中既含有极性共价键,又含有非极性共价键的化合物是(填化学式,写两种).
(3)这些元素形成的含氧酸中,分子的中心原子的价层电子对数为3的酸是;酸根呈三角锥结构的酸是 . (填化学式)
(4)c和e形成的一种离子化合物的晶体结构如图1,则e离子的电荷为 . 
(5)这5种元素形成的一种1:1型离子化合物中,阴离子呈四面体结构,阳离子呈轴向狭长的八面体结构(如图2所示).该化合物中阴离子为 , 阳离子中存在的化学键类型有;该化合物加热时首先失去的组分是 , 判断理由是 . 
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】1994年12月科学家发现了一种新元素,它的原子核内有161个中子,质量数为272,该元素的核电荷数为( )
A. 111B. 272C. 161D. 433
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知A、E为金属单质,B是淡黄色粉末且常用于防毒面具中,回答下题。
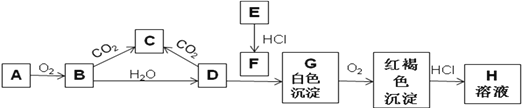
(1)实验室中A常常保存在盛放__________的广口瓶中,A焰色反应为__________色。
(2)写出B转变成C的化学方程式_______________________。该反应中氧化剂是_________,还原剂是___________,0.1molB参与该反应,转移电子的个数为_________ 。
(3)写出D与F反应生成G的离子方程式:____________________________________________。
(4)描述H溶液中金属阳离子的实验室检验方法______________________________________;其涉及到的离子反应方程式为:_________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组溶液中,离子能够大量共存的是( )
A. H+ Cl- Fe2+ NO3-B. OH- Na+ SO42- HCO3-
C. NH4+ Cl- K+ OH-D. F- Na+ OH- NO3-
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com