
鉴别下列各组物质,按要求回答问题。
(1)稀硫酸、稀盐酸
①可选作鉴别的试剂有(填编号,可多选)_________。
A.BaCl2溶液 B.Mg(NO3)2溶液 C.Na2CO3溶液
②鉴别反应的离子方程式:_________________________。
(2)饱和碳酸钠溶液、澄清石灰水
①可选用鉴别的试剂有(填编号,可多选)____。
a.盐酸 b.NaCI c.硝酸 d.BaCl2溶液
②依次写出鉴别中有明显现象的反应的离子方程式:________________________________。
(7分) (1)①A (1分)②Ba2++SO42-=BaS04↓ (1分)
(2)① a. c. d. (3分)②CO32-+2H-=CO2↑+H2O(1分)Ba2++CO32- =BaCO3↓ (1分)
解析试题分析:(1)①可用BaCl2溶液鉴别硫酸和稀盐酸,前者产生白色沉淀,后者不反应。Mg(NO3)2溶液与稀硫酸、稀盐酸不反应,稀硫酸、稀盐酸与Na2CO3溶液反应都产生气体,不能鉴别,故答案为:A;
②稀硫酸和BaCl2溶液发生反应的离子方程式为Ba2++SO42-=BaSO4↓。
(2)①碳酸钠溶液可与盐酸、硝酸反应生成气体,与BaCl2溶液反应生成沉淀,饱和碳酸钠溶液、澄清石灰水与NaCl溶液不反应,不能鉴别,故答案为:acd;
②鉴别中有明显现象的反应的离子方程式为Ba2++CO32-=BaCO3↓;2H++CO32-=CO2↑+H2O。
考点:考查物质鉴别以及检验的有关判断


科目:高中化学 来源: 题型:填空题
钒及化合物用途广泛。工业上常用含少量Al2O3的钒铁矿(FeO×V2O5)碱熔法提取V2O5。简要流程如下:
已知:①焙烧时可发生反应:V2O5 + Al2O3+2Na2CO3 2NaVO3 +2NaAlO2 +2CO2
2NaVO3 +2NaAlO2 +2CO2
②常温下物质的溶解度:NaVO3~21.2 g /100g水;HVO3~0.008 g /100g水
(1)“浸出渣B”的主要成分是 。(写化学式)
(2)生产中,不直接用H2SO4浸泡“烧渣A”获取HVO3的原因是 。
(3)“操作①”包括 、洗涤。如果不洗涤,则产品中可能含有的金属阳离子是 、 。下列装置(部分夹持仪器省去)可用在实验室进行“操作②”的是 。(填序号)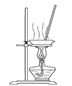

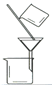
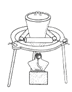
A B C D
(4)NaVO3用于原油的脱硫技术,由V2O5溶于NaOH溶液中制取,反应的离子方程式为 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
某工厂排出的污水中含有大量的Fe2+、Zn2+、Hg2+三种金属离子。以下是某化学研究性学习小组的同学设计的除去污水中的金属离子,回收绿矾、皓矾(ZnSO4·7H2O)和汞的方案。
[药品] NaOH溶液、硫化钠溶液、硫化亚铁、稀硫酸、铁粉
[实验方案]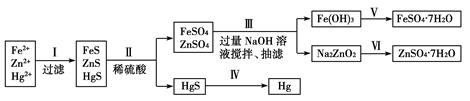
[问题探究]
(1)步骤Ⅱ所发生反应的离子方程式为_________________________________________________。
(2)步骤Ⅲ中的抽滤为减压条件下的过滤,可以加快过滤速度;该步骤涉及反应的离子方程式有Zn2++4OH-=ZnO22-+2H2O和________________。
(3)步骤Ⅵ中得到硫酸锌溶液的离子反应方程式为______________________________。
(4)欲实现步骤Ⅴ,所需加入的试剂有________、________,所涉及的主要操作依次为______________________。
(5)步骤Ⅳ常用的方法是加热,该步骤是否对环境有影响?__________(填“是”或“否”),如有影响,请你设计一个环境保护方案来实现步骤Ⅳ的反应________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
自然界中的物质多数是以混合物的形式存在,下面是混合物的分离和提纯,请填空:
(1)除去NaCl固体中混有的少量CaCO3,所进行的实验操作为: 、 、蒸发、结晶。
(2)除去NaCl中的Na2SO4,依次加入的溶液为(填溶质化学式): 、 、 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
下图是中学化学中常用于混合物的分离和提纯的装置,请根据装置回答问题: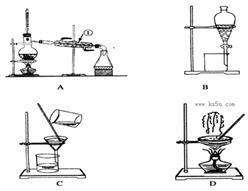
(1)从氯化钾溶液中得到氯化钾固体,选择装置 (填代表装置图的字母,下同);除去自来水中的Cl-等杂质,选择装置 。
(2)从碘水中分离出I2,选择装置 ,该分离方法的名称为 。
(3)装置A中①的名称是 ,进水的方向是从 口进水。装置B在分液时为使液体顺利下滴,应进行的具体操作是 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
用于分离或提纯物质的方法有:A蒸馏(分馏);B萃取;C过滤;D重结晶;E分液。下列各组混合物的分离或提纯应选用上述哪一种方法最合适?(填方法的标号)
(1)淀粉液中含有泥沙 ;
(2)分离四氯化碳与水的混合物 ;
(3)分离汽油和煤油 ;
(4)分离碘水中的碘单质 ;
(5)KNO3晶体中含有少量食盐 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
研究小组欲进行从海水中获取淡水、食盐并提取镁和溴等物质的实验探究。
(1)无需经过化学变化就能从海水中获得的一组物质是 (填序号)。
① Cl2、Br2、I2 ② Na、Mg、Al ③烧碱、氢气 ④食盐、淡水
(2)在生产过程中,从海水中提取镁的流程如下图所示: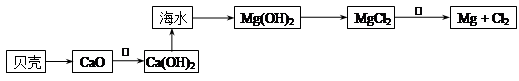
贝壳中的主要成分是:___________(填化学式);反应①属于________反应(填“吸热”或“放热”)。
反应②的化学方程式为 。
(3)实验室从海水样品中提取溴的主要步骤是:向海水样品中通入适量氯气将溴离子氧化,该反应的离子方程式为 ;从反应后的溶液中提取溴单质的实验操作是____________(填实验操作名称)。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
某科研小组以难溶性钾长石(K2O?Al2O3?6SiO2)为原料,提取A12O3、 K2CO3等物质,工艺流程如下: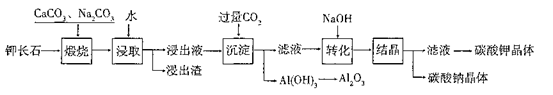
(1)“煅烧”过程中有如下反应发生:
①钾长石中的硅元素在CaCO3作用下转化为CaSiO3,写出SiO2转化为CaSiO3的化学方程式_____________________。
②钾长石中的钾元素和铝元素在Na2CO3作用下转化为可溶性的NaAlO2和 KAlO2,写出Al2O3转化为NaAlO2的化学方程式____________________________。
(2)已知NaAlO2和KAlO2易发生如下反应:AlO2-+2H2O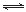 Al(OH)3+OH-。
Al(OH)3+OH-。
“浸取”时,应保持溶液呈______性(填“酸”或“碱”)。“浸取”时不断搅拌的目的是______________。
(3)“转化”时加入NaOH的主要作用是_______ (用离子方程式表示)。
(4)上述工艺中可以循环利用的主要物质是_______、_______和水。
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
(16分)氨基甲酸铵(NH2COONH4)是一种白色固体,受热易分解。某小组模拟制备氨基甲酸铵,反应如下(且温度对反应的影响比较灵敏):2NH3(g)+CO2(g)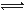 NH2COONH4(s) ΔH<0
NH2COONH4(s) ΔH<0
(1)如用下图I装置制取氨气,可选择的试剂是 。
(2)制备氨基甲酸铵的装置如下图Ⅱ所示,把NH3和CO2通入四氯化碳中,不断搅拌混合,生成的氨基甲酸铵的小晶体悬浮在CCl4中。 当悬浮物较多时,停止制备。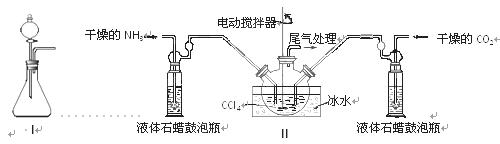
注:CCl4与液体石蜡均为惰性介质。
①发生器用冰水冷却的原因是_________________________________________,液体石蜡鼓泡瓶的作用是 。
②从反应后的混合物中分离出产品的实验方法是 (填写操作名称)。为了得到干燥产品,应采取的方法是________(填写选项序号)。
a.常压加热烘干 b.高压加热烘干 c.减压40℃以下烘干
(3)制得的氨基甲酸铵可能含有碳酸氢铵、碳酸铵中的一种或两种。
①设计方案,进行成分探究,请填写表中空格。
限选试剂:蒸馏水、稀HNO3、BaCl2溶液、澄清石灰水、AgNO3溶液、稀盐酸。
| 实验步骤 | 预期现象和结论 |
| 步骤1:取少量固体样品于试管中,加入蒸馏水至固体溶解。 | 得到无色溶液 |
| 步骤2:向试管中加入过量的BaCl2溶液,静置 | 若溶液不变浑浊,证明固体中不含碳酸铵。 |
| 步骤3:向试管中继续加入 。 | ,证明固体中含有碳酸氢铵。 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com