
下图是中学化学中常用于混合物的分离和提纯的装置,请根据装置回答问题: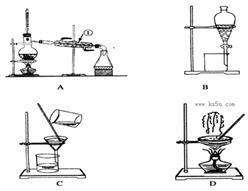
(1)从氯化钾溶液中得到氯化钾固体,选择装置 (填代表装置图的字母,下同);除去自来水中的Cl-等杂质,选择装置 。
(2)从碘水中分离出I2,选择装置 ,该分离方法的名称为 。
(3)装置A中①的名称是 ,进水的方向是从 口进水。装置B在分液时为使液体顺利下滴,应进行的具体操作是 。
 金牌教辅培优优选卷期末冲刺100分系列答案
金牌教辅培优优选卷期末冲刺100分系列答案科目:高中化学 来源: 题型:填空题
有三瓶无色溶液的标签损坏了,只知道它们分别是盐酸、BaCl2溶液和Na2CO3溶液。甲、乙两位同学各用一种试剂,一次性鉴别都取得了成功。甲用的一种指示剂是_________;乙用的一种酸溶液是__________。丙同学没用任何试剂也鉴别成功了,他的鉴别过程是:取样于试管中,编号为a、b、c,然后将三种溶液两两混合,发现a加入b中有气泡产生,a加入c中有白色沉淀产生,则a、b、c分别是________、________、__________。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
铬铁矿的主要成分可表示为FeO·Cr2O3,还含有MgO、Al2O3、Fe2O3等杂质,以下是以铬铁矿为原料制备重铬酸钾(K2Cr2O7)的流程图: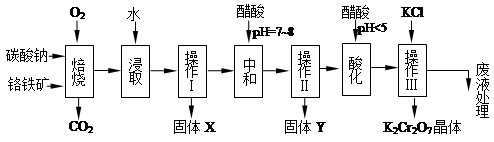
已知:①4FeO·Cr2O3+ 8Na2CO3+ 7O2 8Na2CrO4 + 2 Fe2O3 + 8CO2↑;
8Na2CrO4 + 2 Fe2O3 + 8CO2↑;
②Na2CO3 + Al2O3 2NaAlO2 + CO2↑;③ Cr2O72-+ H2O
2NaAlO2 + CO2↑;③ Cr2O72-+ H2O 2CrO42- + 2H+
2CrO42- + 2H+
根据题意回答下列问题:
(1)固体X中主要含有_________(填写化学式);要检测酸化操作中溶液的pH是否等于4.5,应该使用__________(填写仪器或试剂名称)。
(2)酸化步骤用醋酸调节溶液pH<5,其目的是_________________________________。
(3)操作Ⅲ有多步组成,获得K2Cr2O7晶体的操作依次是:加入KCl固体、蒸发浓缩、 、过滤、_______、干燥。
(4)下表是相关物质的溶解度数据,操作Ⅲ发生反应的化学方程式是:Na2Cr2O7+2KCl →K2Cr2O7↓+2NaCl。该反应在溶液中能发生的理由是_______________。
| 物质 | 溶解度/(g/100g水) | ||
| 0°C | 40°C | 80°C | |
| KCl | 28 | 40.1 | 51.3 |
| NaCl | 35.7 | 36.4 | 38 |
| K2Cr2O7 | 4.7 | 26.3 | 73 |
| Na2Cr2O7 | 163 | 215 | 376 |

查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(Ⅰ)二氧化铈(CeO2)是一种重要的稀土氧化物。平板电视显示屏生产过程中产生大量的废玻璃粉末(含SiO2、Fe2O3、CeO2以及其他少量可溶于稀酸的物质)。某课题组以此粉末为原料回收铈,设计实验流程如下: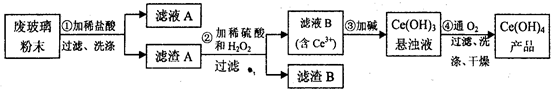
(1)洗涤的目的主要是为了除去Cl-和___________(填离子符号),检验该滤渣A洗净的方法是_____________________。
(2)第②步反应的离子方程式是____________________________。
(3)取上述流程中得到的Ce(OH)4产品0.536 g,加硫酸溶解后,用0.1000mol· L-1FeSO4标准溶液滴定终点时(铈被还原为Ce3+),消耗25.00mL标准溶液,该产品中Ce(OH)4的质量分数为_____________。
(Ⅱ)氧化镁在医药、建筑等行业应用广泛.硫酸镁还原热解制备高纯氧化镁是一种新的探索.以菱镁矿(主要成分为MgCO3,含少量FeCO3)为原料制备高纯氧化镁的实验流程如下: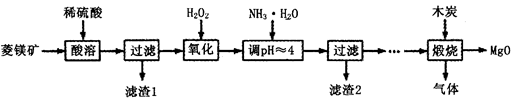
(1)加入H2O2氧化时,发生反应的化学方程式为________________。
(2)滤渣2的成分是______________(填化学式)。
(3)煅烧过程存在以下反应:2MgSO4+C=2MgO+2SO2↑+CO2↑
MgSO4+C=MgO+SO2↑+CO↑ MgSO4+3C=MgO+S↑+3CO↑
利用如图装置对煅烧产生的气体进行分步吸收或收集。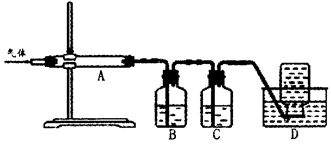
①D中收集的气体可以是______________(填化学式)。
②B中盛放的溶液可以是______________(填字母)。
| A.NaOH溶液 | B.Ca(OH)2溶液 | C.稀硝酸 | D.KMnO4溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
亚氯酸钠(NaClO2)是一种重要的含氯消毒剂,主要用于水的消毒以及砂糖、油脂的漂白与杀菌。以下是过氧化氢法生产亚氯酸钠的工艺流程图:
已知:①NaClO2的溶解度随温度升高而增大,适当条件下可结晶析出NaClO2?3H2O。
②纯ClO2易分解爆炸,一般用稀有气体或空气稀释到10%以下安全。
③160 g/L NaOH溶液是指160 gNaOH固体溶于水所得溶液的体积为1L。
(1)160 g/L NaOH溶液的物质的量浓度为 。若要计算该溶液的质量分数,还需要的一个条件是 (用文字说明)。
(2)发生器中鼓入空气的作用可能是 (选填序号)。
a.将SO2氧化成SO3,增强酸性; b.稀释ClO2以防止爆炸;
c.将NaClO3氧化成ClO2
(3)吸收塔内的反应的离子反应方程式为 。
吸收塔的温度不能超过20℃,其目的是 。
(4)在碱性溶液中NaClO2比较稳定,所以吸收塔中应维持NaOH稍过量,判断NaOH是否过量的简单实验方法是 。
(5)吸收塔中为防止NaClO2被还原成NaCl,所用还原剂的还原性应适中。除H2O2外,还可以选择的还原剂是 (选填序号)。
a.Na2O2 b.Na2S c.FeCl2
(6)从滤液中得到NaClO2?3H2O粗晶体的实验操作依次是 (选填序号)
a.蒸馏 b.蒸发 c.灼烧 d.过滤 e.冷却结晶
要得到更纯的NaClO2?3H2O晶体必须进行的操作是 (填操作名称)
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
鉴别下列各组物质,按要求回答问题。
(1)稀硫酸、稀盐酸
①可选作鉴别的试剂有(填编号,可多选)_________。
A.BaCl2溶液 B.Mg(NO3)2溶液 C.Na2CO3溶液
②鉴别反应的离子方程式:_________________________。
(2)饱和碳酸钠溶液、澄清石灰水
①可选用鉴别的试剂有(填编号,可多选)____。
a.盐酸 b.NaCI c.硝酸 d.BaCl2溶液
②依次写出鉴别中有明显现象的反应的离子方程式:________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
硼镁泥是一种工业废料,主要成份是MgO(占40%),还有CaO、MnO、Fe2O3、FeO、Al2O3、SiO2等杂质,以此为原料制取的硫酸镁,可用于印染、造纸、医药等工业。从硼镁泥中提取MgSO4·7H2O的工艺流程如下: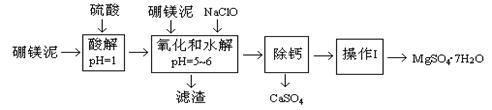
已知:NaClO与Mn2+反应产生MnO2沉淀。
| 沉淀物 | Fe(OH)3 | Al(OH)3 | Fe(OH)2 |
| 开始沉淀pH | 2.3 | 4.0 | 7.6 |
| 完全沉淀pH | 4.1 | 5.2 | 9.6 |
| 温度(℃) | 40 | 50 | 60 | 70 |
| MgSO4 | 30.9 | 33.4 | 35.6 | 36.9 |
| CaSO4 | 0.210 | 0.207 | 0.201 | 0.193 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
多彩水泥的添加剂是CoCl2-6H2O。工定是以含钴废料(含少量Fe、Al等杂质制取CoCl2·6H2O的一种新工艺流程如下图:
已知:①钴与盐酸反应的化学方程式为:Co+2HCl CoCl2+H2↑
②CoCl2·6H2O溶点86oC,易溶于水、乙醚等;常温下稳定无毒,加热至110oC~120OC时,失去结晶水变成有毒的无水氯化钴。
③部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
请回答下列问题:
(1)上述流程中的试剂a可能为 ;其作用是 ;
(2)加入碳酸钠调节pH至b,b的范围是 ;
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Co(OH)2 | Al(OH)3 |
| 开始沉淀(pH) | 2.3 | 7.5 | 7.6 | 3.4 |
| 完全沉淀(pH) | 4.1 | 9.7 | 9.2 | 5.2 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
(12分)硫酸铜在生产、生活中应用广泛。某化工厂用含少量铁的废铜渣为原料生产胆矾的流程如下:
(1)写出浸出时铜与稀硫酸、稀硝酸反应生成硫酸铜的化学方程式: 。
(2)取样检验是为了确认Fe3+是否除净,你的检验方法是 。
(3)滤渣c是 。
(4)气体a可以被循环利用,用化学方程式表示气体a被循环利用的原理为:
2NO+O2 =2NO2、 。
(5)一定温度下,硫酸铜受热分解生成CuO、SO2气体、SO3气体和O2气体,写出硫酸铜受热分解的化学方程式: 。
某同学设计了如下图所示的实验装置分别测定生成的SO2气体、SO3气体的质量和O2气体的体积。此设计有不合理之处,请说明理由: 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com