
【题目】甲醇(CH3OH)是一种重要的化工原料,广泛应用于化工生产,也可以直接用做燃料。
已知:CH3OH(1)+ O2(g) =CO(g) + 2H2O(g) ;△Ha = -443.64 kJ·mol-1
2CO (g) + O2(g) = 2CO2(g) ;△Hb =-566.0 kJ·mol-1
(1)试写出CH3OH(1)在氧气中完全燃烧生成CO2和H2O(g)的热化学方程式: 。
(2) CH3OH和H2的燃烧热分别为△H=-725.5kJ/mol、△H=-285.8kJ/mol,写出工业上以CO2和H2为原料合成CH3OH的热化学方程式____________________。
(3)科研人员新近开发出一种由甲醇和氧气以强碱做电解质溶液的新型手机电池,可使手机连续使用一个月才充一次电,据此回答下列问题: 甲醇在 极反应;电极反应式为 。
(4)利用电池可实现电能向化学能转化。某同学设计了一种电解法制取Fe(OH)2的实验装置(如下图所示),通电后,溶液中产生大量的白色沉淀,且较长时间不变色。下列说法中正确的是 (填序号)
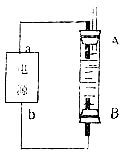
A.电源中的a一定为正极,b一定为负极 B.可以用NaCl溶液作为电解液
C.A、B两端都必须用铁作电极 D.阴极发生的反应是:2H+ + 2e-→H2↑
【答案】(1)2CH3OH(1) +3O2(g) = 2CO2(g) + 4H2O(g);△H =-1453.28kJ·mol-1
(2)CO2(g)+3H2(g) ![]() CH3OH(l)+H2O(l) △H=-131.9kJ/mol
CH3OH(l)+H2O(l) △H=-131.9kJ/mol
(3)负;CH3OH + 8OH--6e-= CO32-+ 6H2O
(4)A、B、D。
【解析】
试题分析:(1)根据题意可知①CH3OH(1) + O2(g) =CO(g) + 2H2O(g) ; △Ha = -443.64 kJ·mol-1;②2CO (g) + O2(g) = 2CO2(g) ; △Hb =-566.0 kJ·mol-1。①×2+②可得CH3OH(1)在氧气中完全燃烧生成CO2和H2O(g)的热化学方程式2CH3OH(1) +3O2(g) = 2CO2(g) + 4H2O(g);△H =-1453.28kJ·mol-1;
(2)CH3OH和H2的燃烧热分别为△H = -725.5kJ/mol、△H = -285.8kJ/mol,可得热化学方程式:①2CH3OH(1) +3O2(g) = 2CO2(g) + 4H2O(g);△H = - 1453.28 kJ·mol-1; ② 2H2(g) + O2(g) = 2H2O(l) △H = -571.6 kJ·mol-1;② × 3/2 - ① × 1/2,整理可得工业上以CO2和H2为原料合成CH3OH的热化学方程式是CO2(g)+3H2(g) ![]() CH3OH(l) + H2O(l) △H = -131.9kJ/mol;
CH3OH(l) + H2O(l) △H = -131.9kJ/mol;
(3)由甲醇和氧气以强碱做电解质溶液的新型手机电池,可使手机连续使用一个月才充一次电,该电池是原电池,通入燃料甲醇的电极是负极,由于是碱性环境,所以甲醇被氧化产生CO32-,电极反应式为CH3OH + 8OH--6e-= CO32-+ 6H2O;
(4)某同学设计了一种电解法制取Fe(OH)2的实验装置(如下图所示),通电后,溶液中产生大量的白色沉淀,且较长时间不变色。说明Fe作阳极,发生氧化反应,H+在阴极发生还原反应,变为H2逸出,使溶液显碱性,Fe2+与OH-结合形成的Fe(OH)2由于在H2的环境,所以Fe(OH)2不会被氧气氧化,使我们可以较长时间观察到沉淀的白色。A.因为生成的氢气将装置中原有氧气带出,且氢气的密度小于水,所以氢气从B端阴极析出,A电极则是铁做阳极失去电子生成亚铁离子,所以“a”为正极,“b”为负极,正确;B.因为阳极是铁,活泼电极作阳极时,阳极材料铁失电子生成亚铁离子,阴极上氢离子放电,生成氢气,所以能生成氢氧化亚铁白色沉淀,则电解液选用NaCl溶液不影响实验,正确;C.阳极应该用铁电极,阴极可以是铁也可以是其他惰性电极,错误;D.阳极应该用铁电极,阴极可以是铁也可以是其他惰性电极,阴极上水得电子生成氢气和氢氧根离子,氢气能防止氢氧化亚铁被氧化而导致实验失败,所以电极反应式为:2H+ + 2e-→H2↑,正确。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】如图所示,向A中充入1molX和1molY,向B中充入2molX和2molY,起始V A =V B =aL,在相同温度和有催化剂的条件下,两容器中各自发生下列反应 X (g) +Y (g) ![]() 2Z (g) +W (g) △H>0。达到平衡时,V A =1.2aL,则下列说法错误的是:
2Z (g) +W (g) △H>0。达到平衡时,V A =1.2aL,则下列说法错误的是:
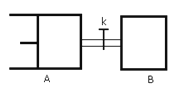
A.反应开始时,B容器中化学反应速率快
B.平衡时,A容器中X的转化率为40%,且比B容器中X的转化率大
C.打开K一段时间达平衡时,A的体积为1.6aL(连通管中气体体积不计)
D.打开K达新平衡后,升高温度,A容器体积一定增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏伽德罗常数的值,下列有关说法不正确的是
A.常温下,48gO3和48gO2含有的原子数目为3NA
B.1molOH-l离子中含电子数目为10 NA
C.0.5L0.2mol·L-1的NaCl溶液中含有的Na+数是0.1 NA
D.33.6LCO中含有的原子总数是3NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某反应体系的物质有:NaOH、Au2O3、Na2S4O6、Na2S2O3、Au2O、H2O。
(1)请将Au2O3之外反应物与生成物分别填入以下空格内。
![]()
(2)反应中,被还原的元素是____________,还原剂是____________。
(3)将氧化剂与还原剂填入空格中,并标出电子转移的方向和数目。
![]()
(4)纺织工业中常用氯气作漂白剂,Na2S2O3可作为漂白后布匹“脱氯剂”,Na2S2O3和Cl2反应的产物是H2SO4、NaCl和HCl,则还原剂与氧化剂物质的量之比为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在0.2L由NaCl、MgCl2、BaCl2组成的混合液中,部分离子浓度大小如右图所示,回答下列问题:
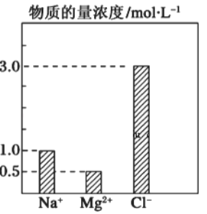
(1)该混合液中含溶质NaCl的物质的量为_________mol,含溶质MgCl2的质量为__________g。
(2)该混合液中含溶质MgCl2的物质的量为____________,将该混合液加水稀释至体积为1L,稀释后溶液中Ba2+的物质的量浓度为_________mol/L
(3)若向该混合液溶液中通入NH3使Mg2+完全沉淀,需要标况下NH3_____________L。
已知MgCl2+2NH3=Mg(OH)2↓+2NH4Cl
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某单官能团链状有机化合物,只含碳、氢、氧三种元素,相对分子质级为74,完全燃烧时产生等物质的量的CO2和H2O,它可能有的结构共有(不考虑立体异构)
A. 2种 B. 3种 C. 4种 D. 5种以上
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有一块铁的“氧化物”样品,用140mL5.0mol·L-1盐酸恰好将之完全溶解,所得溶液还能吸收0.025molCl2,恰好使其中的Fe2+全部转变为Fe3+,则该样品可能的化学式为( )
A. Fe2O3 B. Fe3O4 C. Fe4O5 D. Fe5O7
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于乙烯和苯的叙述中,错误的是( )
A. 乙烯能使溴的四氯化碳溶液褪色 B. 乙烯可以燃烧
C. 苯能使酸性高锰酸钾溶液褪色 D. 苯可以燃烧
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com