
A、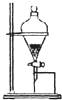 分力乙醇和乙醛 |
B、 实验室制氨气 |
C、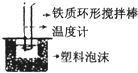 反应热的测定 |
D、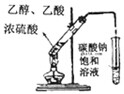 实验室制乙酸乙酯 |
科目:高中化学 来源: 题型:
A、(
| ||||
| B、( 2b-a ) mol/L | ||||
C、( 5b-
| ||||
| D、( l0b-5a )mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:
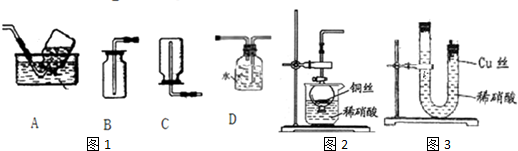
查看答案和解析>>
科目:高中化学 来源: 题型:
| 时间(s) c(mol/L) | 0 | 20 | 40 | 60 | 80 | 100 |
| c(A) | 0.20 | 0.14 | 0.10 | c | d | e |
| c(B) | 0.00 | 0.12 | b | 0.22 | 0.22 | 0.22 |
查看答案和解析>>
科目:高中化学 来源: 题型:
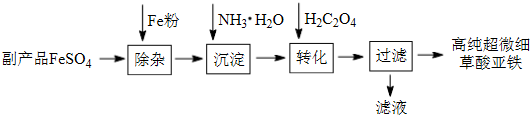
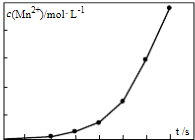
查看答案和解析>>
科目:高中化学 来源: 题型:
| PCl3(g) | Cl2(g) | PCl5(g) | |
| 初始浓度/(mol/L) | 2.0 | 1.0 | 0 |
| 平衡浓度/(mol/L) | c1 | c2 | 0.4 |
| A、10min内,v(Cl2)=0.04mol/(L?min) |
| B、当反应达到平衡时,容器中Cl2为1.2mol |
| C、升高温度,反应的平衡常数减小,则平衡时PCl3的转化率变大 |
| D、平衡后移走2.0mol PCl3和1.0mol Cl2,在相同条件下再达平衡时,c(PCl5)=0.2mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、温度不变,增大容器的体积,液体的颜色变浅 |
| B、温度不变,减少容器的体积,S2Cl2的转化率降低 |
| C、压强不变,升高温度,液体的颜色变浅 |
| D、体积不变,降低温度,氯气的转化率升高 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、分子式为C4H8有机物最多存在4个C-C单键 |
B、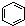 和 和 均是芳香烃, 均是芳香烃, 既是芳香烃又是芳香化合物 既是芳香烃又是芳香化合物 |
C、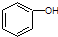 和 和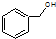 分子组成相差一个-CH2-,因此是同系物关系 分子组成相差一个-CH2-,因此是同系物关系 |
| D、乙酸分子中含有碳氧双键,所以它能使溴水褪色 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、碳和水反应吸收热量131.3 kJ |
| B、1 mol C(s)和1 mol H2O(g)反应生成一氧化碳和氢气,并吸收131.3 kJ的热量 |
| C、1 mol C跟1 mol H2O反应吸收131.3 kJ的热量 |
| D、固体碳和气态水各1 mol反应,放出131.3 kJ的热量 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com