
【题目】下列变化涉及的反应属于加成反应的是( )
A.乙醇→乙醛B.苯→硝基苯
C.乙烯→氯乙烷D.乙醇→乙酸乙酯
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】下列叙述中正确的是( )
①伴有能量变化的物质变化都是化学变化 ②物质发生化学反应都伴随能量变化
③所有的氧化还原反应都是放热反应 ④所有的燃烧反应都是放热反应
⑤需要加热才能发生的的反应一定是吸热反应 ⑥放热反应在常温下均很容易进行
A. ①②④⑤ B. ②④ C. ②③④ D. 全部
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】橙花叔醇是一种具有香气的有机化合物,可用于配制玫瑰型、紫丁香型等香精,其结构如图所示,下列相关说法正确的是

A. 橙花叔醇的分子式为C15H24O
B. 橙花叔醇能发生氧化、还原、取代、聚合等类型的反应
C. 橙花叔醇与钠和NaOH均能发生反应
D. 橙花叔醇的同分异构体中可能含有苯环
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于反应3Cl2+6NaOH===5NaCl+NaClO3+3H2O,以下叙述正确的是( )
A. Cl2是氧化剂,NaOH是还原剂
B. 被氧化的Cl原子和被还原的Cl原子的个数之比为5∶1
C. Cl2既是氧化剂又是还原剂
D. 每生成1个氧化产物转移6个电子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值。下列有关叙述正确的是
A. 用浓盐酸分别和MnO2、KClO3反应制备1mol氯气,转移的电子数均为2NA
B. 将1molCl2通入水中,HClO、Cl-、ClO-粒子数之和为2NA
C. 常温下,1L pH=2的H2SO4溶液中,硫酸和水电离的H+总数为0.01NA
D. 常温常压下,NO2与N2O4的混合气体46g,原子总数为NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于元素周期表的叙述不正确的是
A. 元素种类最多的族是第ⅢB族B. 第ⅠA族元素单质均能与水反应
C. 第ⅡA族中无非金属元素D. 元素周期表中金属元素的种类比非金属元素多
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】草酸(H2C2O4)溶液与酸性KMnO4溶液反应时,溶液褪色总是先慢后快,某学习小组探究反应过程中使褪色加快的主要原因,过程如下:
【查阅资料】KMnO4溶液氧化H2C2O4的反应历程为:
![]()
【提出假设】假设1:该反应为放热反应
假设2:反应生成的Mn2+对该反应有催化作用
假设3:K+对该反应有催化作用
该小组同学未提出浓度使反应速率加快的假设,原因是 。
【设计、完成实验】(1)称取 g草酸晶体(H2C2O4·2H2O),配置500 mL 0.10 mol/L H2C2O4溶液。
①在上述过程中必须用到的2种定量仪器是托盘天平和 。
②下列操作会使所配溶液浓度偏低的是 (填下列选项的字母序号)。
A.称取草酸晶体时,将草酸晶体放在托盘天平右盘 |
B.定容时俯视刻度线 |
C.将烧杯中溶液转移到容量瓶之前,容量瓶中有少量蒸馏水 |
D.摇匀后,发现溶液液面低于刻度线,立即用胶头滴管加水再定容 |
(2)完成探究,记录数据
实验 | 烧杯中所加试剂及用量(mL) | 控制条件 | 溶液褪色时间(s) | |||
0.10 mol/L | 等浓度 | H2O | 0.50 mol/L | |||
1 | 30 | 20 | 30 | 20 | 18 | |
2 | 30 | 20 | 30 | 20 | 水浴控制温度65 ℃ | 15 |
3 | 30 | 20 | 30 | 20 | 加入少量MnSO4固体 | 3.6 |
4 | 30 | 20 | x | 20 | 加入5 mL 0.10 mol/LK2SO4溶液 | 18 |
则x = ,假设2成立
(3)由于KMnO4能氧化水中有机物等因素,为配制好稳定的KMnO4溶液,其浓度需标定。取10.00 mL 0.10 mol/L H2C2O4溶液于锥形瓶中,加入10 mL 0.50 mol/L稀硫酸,用(2)中KMnO4溶液滴定至锥形瓶中恰好呈浅紫色,且半分钟不褪色,记录数据,平行三次实验,平均消耗KMnO4溶液40.00 mL,则草酸溶液与酸性KMnO4溶液反应的离子方程式为: 。上述实验中KMnO4溶液的物质的量浓度为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现代工业常以氯化钠为原料制备纯碱,部分工艺流程如下:
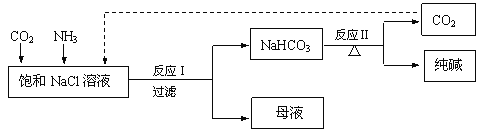
已知反应I为:NaCl + CO2 + NH3 + H2O === NaHCO3↓+ NH4Cl
(1)海水中含有大量的NaCl,以及少量的Ca2+、Mg2+、SO42等离子。
① 为得到纯净的饱和NaCl溶液,进行了如下操作。请补全操作步骤:
a.向浓缩后的海水中加入过量的氢氧化钠溶液后,过滤;
b.向滤液中加入过量___________________(填试剂名称),过滤;
c.向滤液中加入过量___________________(填试剂名称),过滤;
d.向滤液中加入足量的稀盐酸;
e.加热煮沸一段时间,得到饱和NaCl溶液。
② 步骤c中反应的离子方程式是______________________。
(2)反应II的化学方程式是_________________________。
(3)制得的纯碱中含有少量NaCl。取5.5 g纯碱样品加入足量稀硫酸,得到标准状况下1120 mL CO2。则样品中纯碱的质量分数是_________%(保留1位小数)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com