
【题目】某温度时,使用一对石墨电极电解饱和Na2SO4溶液,当转移2mol电子时停止电解,析出Na2SO410H2O晶体m g,所有数据都在相同温度下测得,下列叙述正确的是( )
A.电解后溶液质量减少(m+36)g
B.原溶液中Na2SO4的质量分数为 ![]()
C.若其它条件不变,将石墨电极替换为铜电极,则阴极析出2mol H2
D.若其它条件不变,将石墨电极替换为铜电极,则析出Na2SO4?10H2O晶体仍为m g
【答案】B
【解析】解:用石墨电极电解饱和硫酸钠溶液时,阳极上生成氧气、阴极上生成氢气,所以实质上是电解水,当电解1mol水时转移2mol电子,所以当转移2mol电子时生成实际上是电解1mol水,其质量为18g, A.电解后溶液质量减少量=电解水的质量+析出晶体质量=(18+m)g,故A错误;
B.析出硫酸钠的质量= ![]() =
= ![]() mg,溶液质量=(18+m)g,溶液质量分数=
mg,溶液质量=(18+m)g,溶液质量分数= ![]() =
= ![]() =
= ![]() ,故B正确;
,故B正确;
C.若其它条件不变,将石墨电极替换为铜电极,阴极上仍然是氢离子放电生成氢气,但阳极上Cu失电子生成铜离子,阴极析出1mol H2 , 故C错误;
D.若其它条件不变,将石墨电极替换为铜电极,阳极上生成铜离子、阴极上生成氢气同时还有OH﹣生成,铜离子和OH﹣反应生成Cu(OH)2沉淀,其电池反应式为Cu+2H2O ![]() Cu(OH)2↓+H2↑,根据方程式知,转移2mol电子时消耗2mol水,则析出Na2SO410H2O晶体为2m g,故D错误;
Cu(OH)2↓+H2↑,根据方程式知,转移2mol电子时消耗2mol水,则析出Na2SO410H2O晶体为2m g,故D错误;
故选B.


 应用题作业本系列答案
应用题作业本系列答案科目:高中化学 来源: 题型:
【题目】用辉铜矿(主要成分为Cu2S,含少量Fe2O3、SiO2等杂质)制备碱式碳酸铜的流程如下:
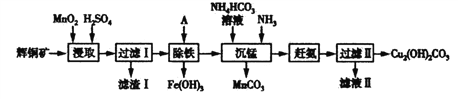
(1)辉铜矿中铜元素的价态为_________________。
(2)滤渣Ⅰ的成分除了不溶性矿渣外,还有S、__________、______________,写出“浸取”过程中生成S 的离子方程式_______________________。
(3)也可用FeCl3代替MnO2作浸取剂。若向FeCl3浸取液中加入CuCl2 ,能加快铜元素的浸取速率,该过程的反应原理可用化学方程式表示为:①Cu2S+2CuCl2=4CuCl+S;②____________。
(4)“沉锰”时发生的反应的离子方程式为____________________。
(5)滤液Ⅱ经结晶得到的盐主要是____________(填化学式,下同),流程中可循环的物质是_________________。
(6)辉铜矿可由黄铜矿(主要成分为CuFeS2)通过电化学反应转变而成,有关转化见下图,转化时负极的电极 反应式为___________________。
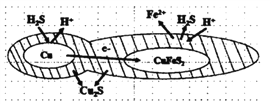
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】加热N2O5,依次发生的分解反应为:①N2O5(g)![]() N2O3(g)+O2(g),②N2O3(g)
N2O3(g)+O2(g),②N2O3(g)![]() N2O(g)+O2(g)。在容积为2L的密闭容器中充入8mol N2O5,加热到t℃,达到平衡状态后O2为9mol,N2O3为3.4mol,则t℃时反应①的平衡常数为( )
N2O(g)+O2(g)。在容积为2L的密闭容器中充入8mol N2O5,加热到t℃,达到平衡状态后O2为9mol,N2O3为3.4mol,则t℃时反应①的平衡常数为( )
A. 4.25 B. 8.5 C. 17 D. 22.5
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用中和滴定法测定烧碱的纯度,若烧碱中不含有与酸反应的杂质,试根据实验回答:
(1)准确称取4.1g烧碱样品.将样品配成250mL待测液,需要的仪器除了小烧杯、玻璃棒、量筒还需要 .
(2)取10.00mL待测液,用量取.
(3)用0.2010molL﹣1标准盐酸滴定待测烧碱溶液,甲基橙做指示剂,滴定时左手旋转滴定管的玻璃活塞,右手不停地摇动锥形瓶,两眼注视的现象时即到达滴定终点.
(4)根据下列数据,计算待测烧碱溶液的纯度: . (保留四位有效数字)
滴定次数 | 待测液体积 | 标准盐酸体积(mL) | |
滴定前读数(mL) | 滴定后读数(mL) | ||
第一次 | 10.00 | 0.50 | 20.40 |
第二次 | 10.00 | 0.10 | 22.10 |
第三次 | 10.00 | 4.00 | 24.10 |
(5)以下操作会造成测量结果偏高的是 ①用蒸馏水冲洗锥形瓶;
②在滴定过程中不慎将数滴酸液滴在锥形瓶外;
③读数时,滴定前仰视,滴定后俯视;
④装标准液之前,没有用标准液润洗滴定管.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】把碎纸片b补充到a中,可得到一个完整的离子方程式(未配平)。下列说法正确的是( )

A. 反应物微粒是S、SO![]() 、OH-
、OH-
B. 该反应可能在酸性条件下进行
C. 氧化剂与还原剂的物质的量之比为2∶1
D. 2 mol S参加反应时,转移的电子数为3NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列解释事实的方程式不正确的是
A. 向燃煤中加入石灰石可减少SO2的排放:2CaCO3 + O2 + 2SO2 ![]() 2CaSO4 + 2CO2
2CaSO4 + 2CO2
B. 足量铁粉与稀硝酸反应:Fe+4H++NO3- = Fe3++2H2O+NO↑
C. 用氨水除去烟气中的SO2:SO2+2NH3H2O=(NH4)2SO3+H2O
D. 用熟石灰处理泄漏的液氯:2Ca(OH)2 +2Cl2 = CaCl2 + Ca(ClO)2 +2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物X是合成二氢荆芥内酯的重要原料,其结构简式为 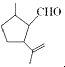 ,下列检验X中既含碳碳双键又含醛基的试剂和顺序正确的是( )
,下列检验X中既含碳碳双键又含醛基的试剂和顺序正确的是( )
A.先加酸性高锰酸钾溶液,后加银氨溶液,加热
B.先加溴水,后加酸性高锰酸钾溶液
C.先加银氨溶液,加热,再加入溴水
D.先加入新制氢氧化铜悬浊液,加热,取清液酸化后再加溴水
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某工厂的工业废水中含有大量的Fe2+、SO42-和较多的Cu2+及少量的Na+。为了减少污染并变废为宝,工厂计划从该废水中回收硫酸亚铁和金属铜。请根据流程图,在方框和 括号内填写物质名称(或主要成分的化学式)或操作方法,完成回收硫酸亚铁和铜的简单实 验方案。
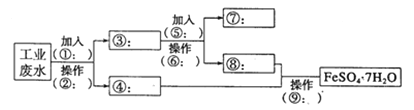
(1)操作②的名称为__________,所需要的玻璃仪器为__________、玻璃棒、烧杯。
(2)试剂⑤的化学式为__________,发生化学反应的离子方程式为__________。
(3)为验证溶液⑧中含有SO42-:取少量的溶液⑧于试管中,先加入____再加入__________,若观察到有白色沉淀,则说明溶液⑧中含有SO42-。写出上述反应的离子方程式______________________________.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com