
����Ŀ��ij�����ۺϴ�����![]() ��ˮ��ҵ��������Ҫ��N2��CO2��SO2��NO��CO�������������ɷ֣���������ͼ��ʾ��
��ˮ��ҵ��������Ҫ��N2��CO2��SO2��NO��CO�������������ɷ֣���������ͼ��ʾ��

��1������1����Ҫ�ɷֳ�Ca(OH)2�⣬����____��____���ѧʽ����
��2��Ϊʹ��Ӧ���е��й����屻������գ��ɲ�ȡ�Ĵ�ʩ�У�������Ӵ��������____��
��3����֪��
2NO2+2NaOH=NaNO3+NaNO2+H2O
NO2+NO+2NaOH=2NaNO2+H2O
Ϊȷ����Ӧ��ֻ����NaNO2��������Ӧ����NO��O2�����ʵ���֮��Ϊ____����ʱ��Ӧ�ܵ����ӷ���ʽΪ____����n(NO) :n(O2)=3:1����NaOH��Һ��������������Һ1��NaNO3��NaNO2�����ʵ���֮��Ϊ____��
���𰸡� CaCO3 CaSO3����CaSO4����˳��ɵߵ��� ������������� 4:1 ![]() 1:5
1:5
����������ҵ������CO2��SO2�ɱ�ʯ��ˮ���գ����ɹ���1ΪCaCO3��CaSO3������ʯ���飬����1�Dz��ܱ�����ʯ��ˮ���յ�N2��NO��CO������1ͨ����������һ������ת��Ϊ����������������������Һ������NaNO2�� NaNO2�뺬��NH4+����Һ��Ӧ���ɵ�����������2����CO��N2��������������������Ҫ��CO��
(1)������������������1����Ҫ�ɷֳ�Ca(OH)2�⣬����CaCO3��CaSO3���ʴ�Ϊ��CaCO3��CaSO3��
(2)Ϊʹ��Ӧ���е��й����屻������գ��ɲ�ȡ�Ĵ�ʩ�У�������Ӵ�������ڿ�����������ٲ�Ҫ���죬�ʴ�Ϊ��������������٣�
(3)��2NO + O2 = 2NO2����NO2+NO+2NaOH=2NaNO2+H2O������+����2��4NO + O2+4NaOH=4NaNO2+4H2O��Ϊȷ����Ӧ��ֻ����NaNO2��������Ӧ����NO��O2�����ʵ���֮��4:1����Ӧ����NO2-��NH4+��Ӧ���ɵ�������Ӧ��NO2-��NԪ�ػ��ϼ۽��ͣ�NH4+��NԪ�ػ��ϼ����ߣ�O��H���ϼ۲��䣬Ӧ������ˮ����Ӧ�����ӷ���ʽΪ![]() ����������Ϊ1mol��ʣ��1molNO������2NO + O2 = 2NO2����Ӧ����2mol NO2������NO2+NO+2NaOH=2NaNO2+H2O����Ӧ����NaNO22mol����Ӧ��ʣ��1mol NO2������2NO2+2NaOH=NaNO3+NaNO2+H2O��Ӧ����NaNO3��NaNO2��0.5mol�����NaNO3��NaNO2�����ʵ���֮��Ϊ0.5:2.5=1:5���ʴ�Ϊ��4:1��
����������Ϊ1mol��ʣ��1molNO������2NO + O2 = 2NO2����Ӧ����2mol NO2������NO2+NO+2NaOH=2NaNO2+H2O����Ӧ����NaNO22mol����Ӧ��ʣ��1mol NO2������2NO2+2NaOH=NaNO3+NaNO2+H2O��Ӧ����NaNO3��NaNO2��0.5mol�����NaNO3��NaNO2�����ʵ���֮��Ϊ0.5:2.5=1:5���ʴ�Ϊ��4:1��![]() ��1:5��
��1:5��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ͼ��ʾ���׳ص��ܷ�ӦʽΪ��N2H4��O2=N2+2H2O�����й��ڸõ�ع���ʱ��˵����ȷ����

A. ��װ�ù���ʱ��Ag�缫������������
B. �׳غ��ҳ��е���Һ��pH����С
C. �׳��и�����ӦΪN2H4-4e-=N2+4H+
D. ���׳�������0.1molN2H4ʱ���ҳ���������������6.4g����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����з����У��Ⱥ��ЦҼ��ֺ��Цм����ǣ� ��
A. CH4 B. HCl C. CH2=CH2 D. F2
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���״���һ������ȼ�ϣ��ڹ�ҵ�ϳ���CO��H2�ϳɼ״�����Ӧ����ʽΪCO (g)+H2(g)![]() CH3OH(g)����֪����CO(g)+1/2O2(g)=CO2(g) ��H1=��283.0 kJ/mol����H2(g)+1/2O2(g)=H2O(g) ��H2=��241.8 kJ/mol����CH3OH(g)+3/2O2(g)=CO2(g)+2H2O(g) ��H3=��192.2 kJ/mol���ش��������⣺
CH3OH(g)����֪����CO(g)+1/2O2(g)=CO2(g) ��H1=��283.0 kJ/mol����H2(g)+1/2O2(g)=H2O(g) ��H2=��241.8 kJ/mol����CH3OH(g)+3/2O2(g)=CO2(g)+2H2O(g) ��H3=��192.2 kJ/mol���ش��������⣺
��1������CO(g)+2H2(g)![]() CH3OH(g)�ķ�Ӧ����H4=_________________��
CH3OH(g)�ķ�Ӧ����H4=_________________��
��2�����ھ��ȡ����ݵ��ܱ������г���1 mol CO��2 mol H2��������ӦCO(g)+2H2(g)![]() CH3OH(g)������ʾ��ͼ��ȷ����˵���ڽ��е�t1ʱ��Ϊƽ��״̬����________����ѡ����ĸ����
CH3OH(g)������ʾ��ͼ��ȷ����˵���ڽ��е�t1ʱ��Ϊƽ��״̬����________����ѡ����ĸ����

��3��T1��ʱ����һ�����Ϊ5 L�ĺ��������г���1 mol CO��2 mol H2������5 min�ﵽƽ�⣬CO��ת����Ϊ0.8��T1��ʱ������һ���������ܱ�������Ҳ����1 mol CO��2 mol H2���ﵽƽ��ʱCO��ת����Ϊ0.7��������������______5 L�����������=������T1��ʱ��CO(g)+2H2(g)![]() CH3OH(g)��ƽ�ⳣ��K=____________��
CH3OH(g)��ƽ�ⳣ��K=____________��
��4����T1��ʱ�������Ϊ5 L�ĺ��������г���һ������H2��CO����Ӧ�ﵽƽ��ʱCH3OH�����������n(H2)/n(CO)�Ĺ�ϵ��ͼ��ʾ���¶Ȳ��䣬��n(H2)/n(CO)=2.5ʱ���ﵽƽ��״̬��CH3OH���������������ͼ���е�________�㡣

��5��Ϊ�����ȼ�ϵ������ʿ��Խ��״����Ϊȼ�ϵ�أ�д��KOH���������Һʱ���״�ȼ�ϵ�صĸ�����Ӧʽ________________________________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��NH3��һ����Ҫ�Ļ���ԭ�ϣ�����������������;�㷺��
��1����֪��
���ۼ� | ����/ kJ��mol-1 |
H�DH | 436 |
N��N | 946 |
N�DH | 391 |
ע������̬������1 molij�ֹ��ۼ���Ҫ���յ����������Ǹù��ۼ��ļ��ܡ�
N2 (g)��3 H2 (g)![]() 2 NH3 (g) H =____kJ��mol-1
2 NH3 (g) H =____kJ��mol-1
��2��һ���¶��£�����ݵ��ܱ������г���N2��H2������Ӧ��N2 ��3H2 ![]() 2NH3����ø����Ũ����ʱ��仯��ͼ1��ʾ��
2NH3����ø����Ũ����ʱ��仯��ͼ1��ʾ��
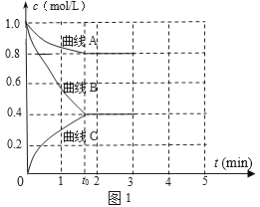
�ٱ�ʾc(N2)��������__�������A����������B��������C������
��0��t0ʱ��H2��ʾ��Ӧ����v(H2)____mol��L-1��min-1��
��������˵���÷�Ӧ�ﵽƽ�����____��
a����������ѹǿ���ٱ仯
b��2c(H2)= 3c(NH3)
c�����������������ٱ仯
d��NH3������������ٱ仯
��3��DZͧ��ʹ�õ�Һ��-Һ��ȼ�ϵ�ع���ԭ����ͼ2��ʾ��
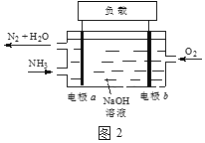
�ٵ缫b������____��
�ڵ������Һ��OH-������____�ƶ�����缫a���缫b������
�۵缫a�ĵ缫��ӦʽΪ____��
��4����ͨ��NH3��NaClO��Ӧ���Ƶû��ȼ���£�N2H4�����÷�Ӧ�Ļ�ѧ��Ӧ����ʽ��____��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij�¶��£���Cl2ͨ��NaOH��Һ�У���Ӧ�õ�NaCl��NaClO��NaClO3�Ļ��Һ�����ⶨClO-��ClO3- ��Ũ��֮��Ϊ1��1����Cl2��NaOH��Һ��Ӧʱ����ԭ����Ԫ���뱻��������Ԫ�ص����ʵ���֮��Ϊ
A��4��1 B��11��3 C��3��1 D��21��5
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ϩ��������5���Ҽ���һ���м������Ƿֱ��ǣ� ��
A.sp2�ӻ�����γɦҼ���δ�ӻ���2p����γɦм�
B.sp2�ӻ�����γɦм���δ�ӻ���2p����γɦҼ�
C.C��H֮����sp2�γɵĦҼ���C��C֮����δ�μ��ӻ���2p����γɵĦм�
D.C��C֮����sp2�γɵĦҼ���C��H֮����δ�μ��ӻ���2p����γɵĦм�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���϶���ϸ���к���DNA������������ת�����ܵĽṹ�ǣ� ��
A. ������B. Ҷ����C. ������D. �������Ҷ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ѧ������������ء����������г������ʵ������뻯ѧʽ���Ӧ���ǣ� ��
A.�մ�NaHCO3
B.��������ZnSO4
C.�ƾ�����C2H5OH
D.��ʯ�ҡ���Ca(OH)2
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com