
| A、2H2(g)+O2(g)═2H2O(l);△H1 2H2(g)+O2(g)═2H2O(g);△H2 | ||||
| B、S(g)+O2(g)═2SO2(g);△H1 S(s)+O2(g)═2SO2(g);△H2 | ||||
C、C(s)+
| ||||
D、H2(g)+Cl2(g)═2HCl(g);△H1
|


 100分闯关期末冲刺系列答案
100分闯关期末冲刺系列答案科目:高中化学 来源: 题型:
| A、乙烯和甲烷可用溴的四氯化碳溶液鉴别 |
| B、乙酸可与NaHCO3溶液反应生成CO2 |
| C、蛋白质和油脂在一定条件下都能水解 |
| D、葡萄糖和麦芽糖互为同系物 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、K2MnO4、KMnO4、MnO2三者中Mn元素的化合价逐渐升高 |
| B、NaCl、Na2CO3、NaOH三者饱和溶液的pH逐渐变大 |
| C、NH4NO3、NaCl、CaO三者溶于水后,所得溶液的温度逐渐降低 |
| D、金、银、铜金属活动性顺序逐渐减弱 |
查看答案和解析>>
科目:高中化学 来源: 题型:
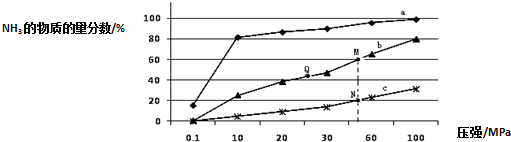

查看答案和解析>>
科目:高中化学 来源: 题型:
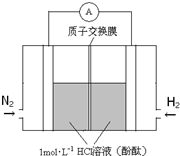 研究氮的固定具有重要意义.
研究氮的固定具有重要意义.| 序号 | 第一组 | 第二组 | 第三组 | 第四组 |
| t/℃ | 30 | 40 | 50 | 80 |
| NH3生成量/(10-6mol) | 4.8 | 5.9 | 6.0 | 2.0 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、升高温度 |
| B、减小压强 |
| C、使用催化剂 |
| D、增大SO2的浓度 |
查看答案和解析>>
科目:高中化学 来源: 题型:

| A、甲池中,b电极是负极 |
| B、a电极的电极反应式C2H5OH+16OH--12e-═2CO32-+11H2O |
| C、一段时间后,用湿润淀粉KI试纸靠近乙池d电极变蓝放电 |
| D、乙池在反应前后溶液的pH不变充电 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com