研究氮的固定具有重要意义.
(1)雷雨天气中发生自然固氮后,氮元素转化为
而存在于土壤中.处于研究阶段的化学固氮新方法是N
2在催化剂表面与水发生如下反应:
2N
2(g)+6H
2O(l)=4NH
3(g)+3O
2(g)△H K ①
已知:N
2(g)+3H
2(g)=2NH
3(g)△H
1=-92.4kJ?mol
-1 K
1②
2H
2(g)+O
2(g)=2H
2O(l)△H
2=-571.6kJ?mol
-1 K
2③
则△H=
;K=
(用K
1和 K
2表示).
(2)在四个容积为2L的密闭容器中,分别充入1mol N
2、3mol H
2O,在催化剂条件下进行反应①3h,实验数据见下表:
| 序号 | 第一组 | 第二组 | 第三组 | 第四组 |
| t/℃ | 30 | 40 | 50 | 80 |
| NH3生成量/(10-6mol) | 4.8 | 5.9 | 6.0 | 2.0 |
下列能说明反应①达到平衡状态的是
(填字母).
a.NH
3和O
2的物质的量之比为4:3
b.反应混合物中各组份的质量分数不变
c.单位时间内每消耗1molN
2的同时生成2molNH
3d.容器内气体密度不变
若第三组反应3h后已达平衡,第三组N
2的转化率为
;第四组反应中以NH
3表示的反应速率是
,与前三组相比,NH
3生成量最小的原因可能是
.
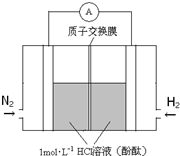
(3)美国化学家发明一种新型催化剂可以在常温下合成氨,将其附着在电池的正负极上实现氮的电化学固定,其装置示意图如图:则开始阶段正极反应式为
;忽略电解过程中溶液体积变化,当电池中阴极区溶液pH=7时,溶液中NH
3?H
2O的浓度为
( K
b=2×10
-5mol?L
-1);当电池中阴极区呈红色时,溶液中离子浓度由大到小的顺序为
.

 研究氮的固定具有重要意义.
研究氮的固定具有重要意义.

 在一体积为10L的容器中,通入一定量的2molCO和2molH2O,在850℃时发生如下反应:CO(g)+H2O(g)?CO2(g)+H2(g)△H<0
在一体积为10L的容器中,通入一定量的2molCO和2molH2O,在850℃时发生如下反应:CO(g)+H2O(g)?CO2(g)+H2(g)△H<0
 某补钙剂说明书的部分信息如图所示.小明对该补钙剂十分感兴趣,取10片钙片放入100g稀盐酸中,有效成分刚好完全反应(其他成分不与盐酸反应).剩余固体和液体总质量比反应前减少了2.2g.请完成下列问题:
某补钙剂说明书的部分信息如图所示.小明对该补钙剂十分感兴趣,取10片钙片放入100g稀盐酸中,有效成分刚好完全反应(其他成分不与盐酸反应).剩余固体和液体总质量比反应前减少了2.2g.请完成下列问题: