
| ||
| 含锌废水水质 | 国家环保标准值 | |
| Zn2+浓度/(mg.L-1) | ≤800 | ≤3.9 |
| pH | 1~5 | 6~ |
| ||
| 10 -14 |
| 10 -8 |
| Ksp |
| [c(OH -)] 2 |
| ||
| 10 -14 |
| 10 -8 |
| Ksp |
| [c(OH -)] 2 |
| 1.2×10 -17 |
| (10 -6)2 |


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①②③④ | B、②④①③ |
| C、①③④ | D、②①④ |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、K2MnO4、KMnO4、MnO2三者中Mn元素的化合价逐渐升高 |
| B、NaCl、Na2CO3、NaOH三者饱和溶液的pH逐渐变大 |
| C、NH4NO3、NaCl、CaO三者溶于水后,所得溶液的温度逐渐降低 |
| D、金、银、铜金属活动性顺序逐渐减弱 |
查看答案和解析>>
科目:高中化学 来源: 题型:
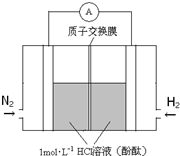 研究氮的固定具有重要意义.
研究氮的固定具有重要意义.| 序号 | 第一组 | 第二组 | 第三组 | 第四组 |
| t/℃ | 30 | 40 | 50 | 80 |
| NH3生成量/(10-6mol) | 4.8 | 5.9 | 6.0 | 2.0 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1 mol Cu与足量稀HNO3反应,转移3nA个电子 |
| B、常温常压下,22.4LCl2含有2nA个Cl原子 |
| C、16gCH4含有10nA个电子 |
| D、1LO.1 mol.L-1Na2SO3溶液中含有O.1nA个S032- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com