
| ||
| ||
| ||
| ||


 尖子生新课堂课时作业系列答案
尖子生新课堂课时作业系列答案科目:高中化学 来源: 题型:
| A、医疗上可用硫酸钡作x射线透视肠胃的内服药,是因为硫酸钡不溶于水 |
| B、酸雨指25℃时pH值小于7的降水 |
| C、加碘食盐中添加碘酸钾而不用碘化钾,是因为碘酸钾能溶于水而碘化钾不溶于水 |
| D、发酵粉能使焙制出的糕点疏松多孔,是因为发酵粉中含有碳酸氢钠 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
 具有复合官能团的复杂有机物:官能团具有各自的独立性,在不同条件下所发生的化学性质可分别从各官能团讨论.如:具有三个官能团分别是(填名称):
具有复合官能团的复杂有机物:官能团具有各自的独立性,在不同条件下所发生的化学性质可分别从各官能团讨论.如:具有三个官能团分别是(填名称):查看答案和解析>>
科目:高中化学 来源: 题型:
| A、乙烯和甲烷可用溴的四氯化碳溶液鉴别 |
| B、乙酸可与NaHCO3溶液反应生成CO2 |
| C、蛋白质和油脂在一定条件下都能水解 |
| D、葡萄糖和麦芽糖互为同系物 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、13种 | B、14种 |
| C、15种 | D、16种 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①②③④ | B、②④①③ |
| C、①③④ | D、②①④ |
查看答案和解析>>
科目:高中化学 来源: 题型:
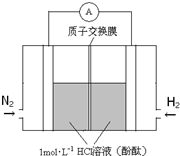 研究氮的固定具有重要意义.
研究氮的固定具有重要意义.| 序号 | 第一组 | 第二组 | 第三组 | 第四组 |
| t/℃ | 30 | 40 | 50 | 80 |
| NH3生成量/(10-6mol) | 4.8 | 5.9 | 6.0 | 2.0 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com