分析:(1)依据盖斯定律结合题干热化学方程式计算得到;
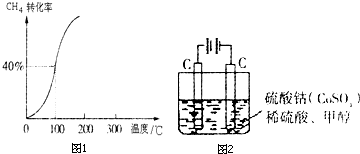
(2)①100°时甲烷的转化率为40%,变化的甲烷为0.4mol,生成的氢气依据反应①CH
4(g)+H
2O(g)=CO(g)+3H
2(g)△H=+206.0kJ/mol;可知氢气物质的量为1.2mol,依据反应速率概念计算;
②依据化学平衡三段式计算平衡浓度、根据平衡常数的概念计算得到;
(3)在压强为0.1MPa、温度为300℃条件下,将1.0molCO与2.0molH
2的混合气体在催化剂作用下发生反应Ⅱ生成甲醇,CO(g)+2H
2(g)=CH
3OH(g)△H=-129.0kJ/mol;
平衡后将容器的容积压缩到原来的
,其他条件不变,体积减小压强增大,反应速率增大,平衡正向进行;
(4)①平衡标志是反应的正逆反应速率相同,各组分浓度保持不变;
②负极上甲醇失电子和碳酸根离子反应生成二氧化碳和水;电解质中的阳离子移向正极;
(5)①通电后,将Co
2+氧化成Co
3+,电解池中阳极失电子发生氧化反应,电极反应为Co
2+-e
-=Co
3+;
②以Co
3+做氧化剂把水中的甲醇氧化成CO
2而净化的离子方程式结合氧化还原反应的实质原子守恒,电荷守恒配平书写为:6Co
3++CH
3OH+H
2O=CO
2↑+6Co
2++6H
+;
③根据电极上转移电子的量相等结合电极反应方程式来判断.
解答:
解:(1)依据盖斯定律结合题干热化学方程式计算得到;①CH
4(g)+H
2O(g)=CO(g)+3H
2(g)△H=+206.0kJ/mol;②CO(g)+2H
2(g)=CH
3OH(g)△H=-129.0kJ/mol
①-②得到CH
4(g)与H
2O(g)反应生成CH
3OH(g)和H
2(g)的热化学方程式为:CH
4(g)+H
2O(g)=CH
3OH(g)+H
2(g)△H=+77.0kJ/mol;
故答案为:CH
4(g)+H
2O(g)=CH
3OH(g)+H
2(g)△H=+77.0kJ/mol;
(2)①100°时甲烷的转化率为40%,变化的甲烷为0.4mol,生成的氢气依据反应①CH
4(g)+H
2O(g)=CO(g)+3H
2(g)△H=+206.0kJ/mol;可知氢气物质的量为1.2mol,用H
2表示该反应的平均反应速率=
=0.0024mol/(L?min);故答案为:0.0024mol/(L?min);
②依据化学平衡三段式计算平衡浓度、根据平衡常数的概念计算得到
CH
4(g)+H
2O(g)=CO(g)+3H
2(g)
起始量(mol/L)0.01 0.02 0 0
变化量(mol/L) 0.004 0.004 0.004 0.012
平衡量(mol/L)0.006 0.016 0.004 0.012
K=
| c(CO)?c3(H2) |
| c(CH4)?c(H2O) |
=
=7.2×10
-5(mol/L)
2故答案为:7.2×10
-5(mol/L)
2;
(3)在压强为0.1MPa、温度为300℃条件下,将1.0molCO与2.0molH
2的混合气体在催化剂作用下发生反应Ⅱ生成甲醇,CO(g)+2H
2(g)=CH
3OH(g)△H=-129.0kJ/mol;
平衡后将容器的容积压缩到原来的
,其他条件不变,体积减小压强增大,反应速率增大,平衡正向进行
a、体积减小,c(H
2)增大,故a错误;
b、压强增大,正逆反应速率都加快,故b错误;
c、体积减小,压强增大,平衡正向进行,CH
3OH的物质的量增加,故c正确;
d、体积减小,压强增大,平衡正向进行,重新平衡时
减小,故d正确;
e、平衡常数K只随温度的而变化,故e错误;
故选cd;
(4)①恒温恒容的容器内进行反应CH
3OH(g)═CO(g)+2H
2(g),
a.2v
逆(CO)=v
正(H
2),正逆反应速率相等,证明反应达到平衡,故正确;
b.CH
3OH的百分含量不再变是平衡的特征,故正确;
c.混合气体的密度等于气体质量和容器体积的比值,反应过程中气体质量守恒,容器体积相同,密度不变,不能证明反应达到平衡,故错误;
d.c(CO):c(H
2):c(CH
3OH)=1:2:1不能证明反应达到了平衡,故错误.
故选ab;
②负极上甲醇失电子和碳酸根离子反应生成二氧化碳和水,电极反应式为CH
3OH-6e
-+3CO
32-=4CO
2+2H
2O,燃料电池中,电解质中的阳离子移向正极,即钾离子移向正极.
故答案为:CH
3OH-6e
-+3CO
32-=4CO
2+2H
2O;正;
(5)①通电后,将Co
2+氧化成Co
3+,电解池中阳极失电子发生氧化反应,电极反应为Co
2+-e
-=Co
3+;故答案为:Co
2+-e
-=Co
3+;
②以Co
3+做氧化剂把水中的甲醇氧化成CO
2而净化的离子方程式结合氧化还原反应的实质原子守恒,电荷守恒配平书写为:6Co
3++CH
3OH+H
2O=CO
2↑+6Co
2++6H
+;
故答案为:6Co
3++CH
3OH+H
2O=CO
2↑+6Co
2++6H
+;
③若该电解槽用铅蓄电池为电源,Pb负极的反应为:Pb+SO
42--2e
-=PbSO
4,根据反应原理:6Co
3++CH
3OH+H
2O=CO
2↑+6Co
2++6H
+则除去32g甲醇转移电子是
6mol,所以至少需要消耗金属铅是3mol,质量是3mol×207g/mol=621g,故答案为:621.



 中考利剑中考试卷汇编系列答案
中考利剑中考试卷汇编系列答案 教育世家状元卷系列答案
教育世家状元卷系列答案 黄冈课堂作业本系列答案
黄冈课堂作业本系列答案 单元加期末复习先锋大考卷系列答案
单元加期末复习先锋大考卷系列答案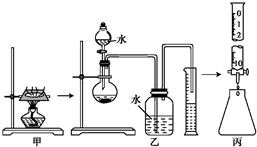 某研究性学习小组对“钠在空气中燃烧的产物”进行了探究.其实验过程为:取一小块钠在空气中加热片刻后与一定量的水反应,收集到V mL(标准状况)气体,向所得溶液中滴入1.000mol?L-1的盐酸溶液30.00mL恰好中和完全.实验装置如图所示.试回答下列问题:
某研究性学习小组对“钠在空气中燃烧的产物”进行了探究.其实验过程为:取一小块钠在空气中加热片刻后与一定量的水反应,收集到V mL(标准状况)气体,向所得溶液中滴入1.000mol?L-1的盐酸溶液30.00mL恰好中和完全.实验装置如图所示.试回答下列问题: