

| A、E表示生成铜的物质的量 |
| B、E表示总反应中消耗水的物质的量 |
| C、F表示反应生成氧气的物质的量 |
| D、F表示生成硫酸的物质的量 |
| ||


科目:高中化学 来源: 题型:
| A、反应热就是反应中放出的能量 |
| B、在任何条件下,化学反应的焓变都等于化学反应的反应热 |
| C、由C(s,石墨)═C(s,金刚石)△H=+1.9kJ?mol-1可知,金刚石比石墨稳定 |
| D、等量的硫蒸气和硫固体分别完全燃烧,前者放出的热量多 |
查看答案和解析>>
科目:高中化学 来源: 题型:
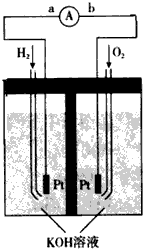 (1)氢氧燃料电池的能量转化主要形式是
(1)氢氧燃料电池的能量转化主要形式是
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
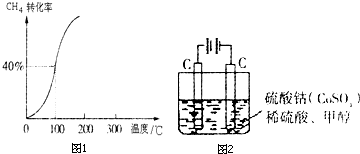
| 1 |
| 2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Na+(g)+Cl-(g)═NaCl(s);△H | ||
B、Na(s)+
| ||
| C、Na(s)═Na(g);△H2 | ||
| D、Na(g)-e-═Na+ (g);△H |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Mg2++2HCO3-+2Ca2++4OH-=Mg(OH)2↓+2CaCO3↓+2H2O |
| B、Zn2++S2-+2H2O=Zn(OH)2↓+H2S↑ |
| C、Cu2++H2S=CuS↓+2H+ |
| D、FeS+2H+=Fe2++H2S↑ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com