
| 试剂 | 操作步骤 | 发生现象 | 结论 | |
| ①氢氧化铜 |
a.将尿液与试剂混合振荡 | 甲.蓝色溶液 | ||
| 乙.生成绿色沉淀 |
||||
| ②斐林试剂 |
b.将尿液与试剂混合后加热至沸腾 | |||
| 丙.生成黄绿色沉淀 | ||||
| ③硫酸铜 | c.将尿液与试剂混合后微热 |
丁.生成黄色沉淀 | ||
| 戊.生成砖红色沉淀 |
| 试剂 | 操作步骤 | 发生现象 | 结论 |
| ①氢氧化铜 | a.将尿液与试剂混合振荡 | 甲.蓝色溶液 | _ |
| 乙.生成绿色沉淀 | + | ||
| ②斐林试剂 | b.将尿液与试剂混合后加热至沸腾 | ||
| 丙.生成黄绿色沉淀 | ++ | ||
| ③硫酸铜 | c.将尿液与试剂混合后微热 | 丁.生成黄色沉淀 | +++ |
| 戊.生成砖红色沉淀 | ++++ |


科目:高中化学 来源: 题型:
| A、1mol N2(g)和3mol H2(g)具有的能量之和低于2 mol NH3(g)具有的能量 |
| B、将1mol N2(g)和3mol H2(g)置于一密闭容器中充分反应后放出Q kJ的热量 |
| C、升高温度,平衡向逆反应方向移动,上述热化学方程式中的Q值减小 |
| D、将一定量N2(g)和H2(g)置于某密闭容器中充分反应后放热Q kJ,则此过程中有3mol H2被氧化 |
查看答案和解析>>
科目:高中化学 来源: 题型:
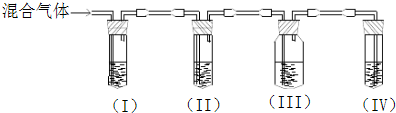
查看答案和解析>>
科目:高中化学 来源: 题型:
| t℃ | 700 | 800 | 850 | 1000 | 1200 |
| K | 2.6 | 1.7 | 1.0 | 0.9 | 0.6 |
| CO | H2O | CO2 | H2 |
| 0.5mol | 8.5mol | 2.0mol | 2.0mol |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 物质 | 分子数 | 质量(g) | 物质的量/mol | 摩尔质量(g/mol) |
| O2 | 16 | |||
| H2SO4 | 6.02×1023 | |||
| H2O | 2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com