
【题目】有A、B、C、D四种金属,当A、B组成原电池时,电子流动方向A →B ;当A、D组成原电池时,A为正极;B与E构成原电池时,电极反应式为:E2++2e-=E,B-2e-=B2+则A、B、D、E金属性由强到弱的顺序为( )
A. A﹥B﹥E﹥D B. A﹥B﹥D﹥E
C. D﹥A﹥B﹥E D. D﹥E﹥A﹥B
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】下列有机物的除杂方法正确的是(括号中的是杂质)
A. 乙酸(乙醛):加入新制的氢氧化铜悬浊液,加热
B. 苯(苯酚):加入溴水,过滤
C. 溴乙烷(溴单质):加入热氢氧化钠溶液洗涤,分液
D. 乙酸乙酯(乙酸):加入饱和碳酸钠溶液洗涤,分液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知下列热化学方程式:
Zn(s)+1/2O2(g)=ZnO(s) ΔH1=-351.1 kJ·mol-1
Hg(l)+1/2O2(g)=HgO(s) ΔH2=-90.7 kJ·mol-1
由此可知Zn(s)+HgO(s)=ZnO(s)+Hg(l) ΔH3,其中ΔH3的值是
A. -441.8 kJ·mol-1 B. -254.6 kJ·mol-1
C. -438.9 kJ·mol-1 D. -260.4 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】肼(N2H4)可作为火箭发动机的燃料。
(1)肼(N2H4)与氧化剂N2O4(l)反应生成N2和水蒸气。已知:
①N2(g)+2O2(g)===N2O4(l) ΔH1=195 kJ·mol1
②N2H4(l)+O2(g)===N2(g)+2H2O(g) ΔH2=534 kJ·mol1
试计算1 mol肼(l)与N2O4(l)完全反应生成N2和水蒸气时放出的热量为________,写出肼(l)和N2O4(l)反应的热化学方程式:________________________________。
(2)有关肼化学反应的能量变化如图所示,已知断裂1 mol化学键所需的能量(kJ):
N≡N为942、O=O为500、N—N为154,则断裂1 mol N—H键所需的能量是________ kJ。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2SO2(g) +O2(g)=2SO3(g)反应过程的能量变化如图所示。已知1mol SO2(g)氧化为1mol SO3(g)的△H=-99KJ/mol。请回答下列问题:
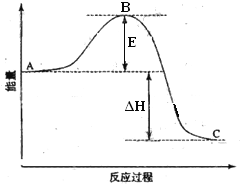
①图中A、C分别表示________、_______;
②E表示________;E的大小对该反应的反应热____(填“有”或“无”)影响。
③该反应通常用V2O5作催化剂,加V2O5会使图△H______(填“变大”、“变小”或“不变”),图中△H =______KJ/mol;
④已知单质硫的燃烧热为296 KJ/mol,计算由S(s)生成3molSO3(g)的△H=________KJ/mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将pH=3的盐酸溶液和pH=11的氨水等体积混合后,溶液中离子浓度关系正确的是
A. c(NH4+)>c(Cl–)>c(H+)>c(OH–) B. c(NH4+)>c(Cl–)>c(OH–)>c(H+)
C. c(Cl–)>c(NH4+)>c(H+)>c(OH–) D. c(Cl–)>c(NH4+)>c(OH–)>c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,由下列实验事实得出结论错误的是
A.SO2使高锰酸钾溶液褪色,说明SO2具有漂白性
B.不小心将浓硫酸溅到手上,应立即用大量的水冲洗
C.常温下浓硫酸可以用铝罐储存,说明铝能在冷的浓硫酸中钝化
D.蔗糖加入浓硫酸后变黑,说明浓硫酸具有脱水性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】绿矾是含有一定量结晶水的硫酸亚铁,在工农业生产中具有重要的用途。某化学兴趣小组对绿矾的一些性质进行探究。回答下列问题:
(1)在试管中加入少量绿矾样品,加水溶解,滴加KSCN溶液,溶液颜色无明显变化。再向试管中通入空气,溶液逐渐变红。由此可知:______________、_______________。
(2)为测定绿矾中结晶水含量,将石英玻璃管(带端开关K1和K2)(设为装置A)称重,记为m1 g。将样品装入石英玻璃管中,再次将装置A称重,记为 m2 g。按下图连接好装置进行实验。

①仪器B的名称是____________________。
②将下列实验操作步骤正确排序___________________(填标号);重复上述操作步骤,直至A恒重,记为m3 g。
a.点燃酒精灯,加热 b.熄灭酒精灯 c.关闭K1和K2
d.打开K1和K2,缓缓通入N2 e.称量A f.冷却至室温
③根据实验记录,计算绿矾化学式中结晶水数目x=________________(列式表示)。若实验时按a、d次序操作,则使x__________(填“偏大”“偏小”或“无影响”)。
(3)为探究硫酸亚铁的分解产物,将(2)中已恒重的装置A接入下图所示的装置中,打开K1和K2,缓缓通入N2,加热。实验后反应管中残留固体为红色粉末。

①C、D中的溶液依次为_________(填标号)。C、D中有气泡冒出,并可观察到的现象分别为_______________。
a.品红 b.NaOH c.BaCl2 d.Ba(NO3)2 e.浓H2SO4
②写出硫酸亚铁高温分解反应的化学方程式_____________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com