
【题目】某小组同学为了获取在Fe(OH)2制备过程中,沉淀颜色的改变与氧气有关的实验证据,用下图所示装置进行了如下实验(夹持装置已略去,气密性已检验)。
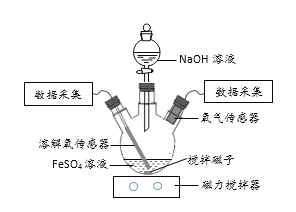
(进行实验)
实验步骤:Ⅰ.向瓶中加入饱和FeSO4溶液,按图1所示连接装置;
Ⅱ.打开磁力搅拌器,立即加入10% NaOH溶液;
Ⅲ.采集瓶内空气中O2含量和溶液中O2含量(DO)的数据。
实验现象:生成白色絮状沉淀,白色沉淀迅速变为灰绿色,一段时间后部分变为红褐色。
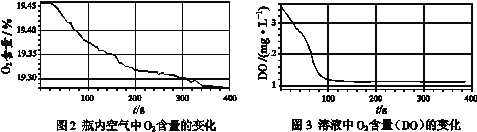
实验数据:
(解释与结论)
(1)搅拌的目的是__________________________。
(2)生成白色沉淀的离子方程式是____________。
(3)红褐色沉淀是__________________________。(填化学式)
(4)通过上述实验,可得到“在Fe(OH)2制备过程中,沉淀颜色改变与氧气有关”的结论,其实验证据是______________________。
(5)写出白色沉淀最终生成红褐色转化的方程式:___________________________。
【答案】使生成的沉淀与氧气充分接触 Fe2++2OH-=Fe(OH)2↓ Fe(OH)3 瓶内空气和溶液中氧气的含量均降低,沉淀颜色改变 4 Fe(OH)2+O2+2H2O=4 Fe(OH)3
【解析】
根据题中Fe(OH)2制备可知,本题考查Fe(OH)2制备即Fe(OH)2的性质,运用Fe(OH)2制备原理和步骤、Fe(OH)2的性质分析。
(1)搅拌可以使生成的沉淀与氧气充分反应;
故答案为:使沉生成的沉淀与氧气充分反应;
(2)生成的白色沉淀是Fe(OH)2,离子方程式是Fe2++2OH-=Fe(OH)2↓;
故答案为:Fe2++2OH-=Fe(OH)2↓;
(3)Fe(OH)2被氧化生成红褐色Fe(OH)3沉淀,所以红褐色沉淀是Fe(OH)3;
故答案为:Fe(OH)3;
(3)由图2和图3可知,瓶内空气中、溶液中O2含量均降低,此时沉淀颜色发生改变,说明“在Fe(OH)2制备过程中,沉淀颜色改变与氧气有关”;
故答案为:瓶内空气和溶液中氧气的含量均降低,沉淀颜色改变;
(4) 白色沉淀是Fe(OH)2,最终生成红褐色是Fe(OH)3,因此白色沉淀最终生成红褐色转化的方程式为4 Fe(OH)2+O2+2H2O=4 Fe(OH)3;
故答案为:4 Fe(OH)2+O2+2H2O=4 Fe(OH)3。


科目:高中化学 来源: 题型:
【题目】下列有关气体体积的叙述正确的是( )
A.一定温度和压强下,各种气态物质体积的大小,由构成气体的分子大小决定
B.一定温度和压强下,各种气态物质体积的大小,由构成气体的分子数决定
C.不同的气体,若体积不同,则它们所含的分子数也不同
D.气体摩尔体积指1mol任何气体所占的体积约为22.4L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙醇是一种重要的化工原料,由乙醇为原料衍生出的部分化工产品如图所示:
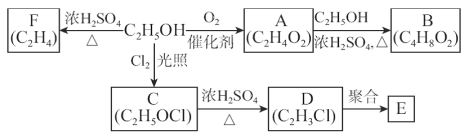
回答下列问题:
(1)D中的官能团名称是________________。
(2)E是一种常见的塑料,其化学名称是___________。
(3)由乙醇生成C的反应类型为___________________。
(4)A→B反应的化学方程式为___________________________。
(5)实验室制取F的化学方程式为_____________。
(6)检验C中非含氧官能团的试剂及方法是____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组物质能用括号内的试剂等鉴别的是 ()
A.![]() 和
和![]() 两种溶液(焰色反应)
两种溶液(焰色反应)
B.NaCl和![]() 两种溶液(激光笔)
两种溶液(激光笔)
C.![]() 溶液
溶液![]() 两种溶液(NaOH溶液)
两种溶液(NaOH溶液)
D.![]() 和
和![]() 两种溶液(KSCN溶液)
两种溶液(KSCN溶液)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁和铝是两种重要的金属,它们的单质及化合物有着各自的性质。在一定温度下,氧化铁可以与一氧化碳发生下列反应:Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g)
(1)该温度下,在2 L盛有Fe2O3粉末的密闭容器中通入CO气体,10 min后,生成了单质铁11.2 g。则10 min内CO的平均反应速率为_________。
(2)请用上述反应中某种气体的有关物理量来说明该反应已达到平衡状态:
①____________________________________________________;
②_____________________________________________________。
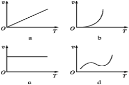
(3)某些金属氧化物粉末和铝粉在镁条的引燃下可以发生铝热反应。下列反应速率(v)和温度(T)的关系示意图中与铝热反应最接近的是___________________。
(4)写出氢氧化铝在水中发生碱式电离的电离方程式:___________________欲使上述体系中铝离子浓度增加,可加入的物质是_____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,下列三个化学反应均能发生:
X2+2W2+![]() 2X-+2W3+
2X-+2W3+
Z2+2X-![]() 2Z-+X2
2Z-+X2
2W3++2Y-![]() 2W2++Y2
2W2++Y2
则在相同条件下,下列三个反应也能发生的是( )
①Y2+2X-![]() 2Y-+X2 ②Z2+2Y-
2Y-+X2 ②Z2+2Y-![]() 2Z-+Y2 ③2W3++2Z-
2Z-+Y2 ③2W3++2Z-![]() 2W2++Z2
2W2++Z2
A. 只有① B. 只有② C. ①和② D. ②和③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上用铝土矿(主要成分为Al2O3,含Fe2O3等杂质)为原料冶炼铝的工艺流程如下:
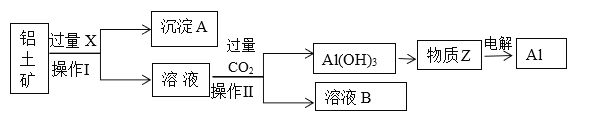
已知:2Al2O3![]() 4Al+3O2↑。
4Al+3O2↑。
(1)操作Ⅱ的名称___________,用到的玻璃仪器有_______________。
(2)X是___________,操作Ⅱ通入过量CO2的离子方程式:______________________________________。
(3)沉淀A的主要成分是________,在生活中有什么应用:________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲、乙、丙、丁四种物质中,甲、乙、丙均含有相同的某种元素,它们之间具有如下转化关系:![]() 。下列有关物质的推断不正确的是
。下列有关物质的推断不正确的是
A. 若甲为Cl2,则丁可能是铁B. 若甲为NH3,则丁可能是氧气
C. 若甲为AlCl3溶液,则丁可能是氨水D. 若甲为NaOH,则丁可能是SO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氧化亚铜(Cu2O)是一种用途广泛的光电材料,某工厂以硫化铜矿石(含CuFeS2、Cu2S等)为原料制取Cu2O的工艺流程如下:
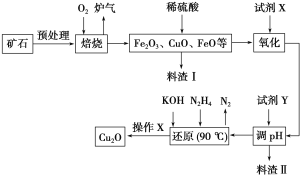
常温下几种物质开始形成沉淀与完全沉淀时的pH如下表:
Fe(OH)2 | Fe(OH)3 | Cu(OH)2 | |
开始沉淀 | 7.5 | 2.7 | 4.8 |
完全沉淀 | 9.0 | 3.7 | 6.4 |
(1)炉气中的有害气体成分是__________,Cu2S与O2反应时,氧化剂与还原剂的物质的量之比为__________。
(2)若试剂X是H2O2溶液,写出相应反应的离子方程式:________。当试剂X是______时,更有利于降低生产成本。
(3)加入试剂Y调pH时,pH的调控范围是___________。
(4)写出用N2H4制备Cu2O的化学方程式:________,操作X包括_________、洗涤、烘干,其中烘干时要隔绝空气,其目的是____________。
(5)以铜与石墨作电极,电解浓的强碱性溶液可制得纳米级Cu2O,写出阳极上生成Cu2O的电极反应式:__________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com