
【题目】(1)常温下,在200 mL氢氧化钡溶液中含有1×10-3mol的钡离子,将此溶液与pH=3的盐酸混合,使其混合溶液的pH=7,应取氢氧化钡溶液和盐酸的体积之比是_________。
(2)25℃时,利用pH试纸测得0.1molL-1醋酸溶液的pH约为3,则可以估算出醋酸的电离常数约为_______;向10mL此溶液中加入少量冰醋酸,忽略溶解过程中溶液温度和体积的微小变化,溶液中c(H+)/c(CH3COOH)的值将_____(填“增大”、“减小”或“无法确定”)。
(3)电化学法是合成氨的一种新方法,其原理如图所示,阴极的电极反应式是_____。

(4)废水中含氮化合物的处理方法有多种。
① NaClO溶液可将废水中的NH4+转化为N2。若处理过程中产生N2 0.672 L(标准状况),则需要消耗0.3 mol·L-1的NaClO溶液______________L。
②在微生物的作用下,NH4+经过两步反应会转化为NO3-,两步反应的能量变化如图所示。则1 mol NH4+(aq)全部被氧化成NO3-(aq)时放出的热量是______________kJ。
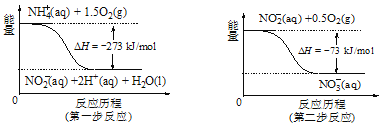
③ 用H2催化还原法可降低水中NO3-的浓度,得到的产物能参与大气循环,则反应后溶液的pH______(填“升高”、“降低”或“不变”)。
(5)常温下,用NaOH溶液作CO2捕捉剂不仅可以降低碳排放,而且可得到重要的化工产品Na2CO3。若某次捕捉后得到pH=10 的溶液,则溶液c(CO32-)∶c(HCO3-)=_______。 [常温下K1(H2CO3)=4.4×10-7、 K2(H2CO3)=5×10-11]。
【答案】1:1010-5mol·L-1减小N2+6H++6e- = 2NH30.3346升高1:2或0.5
【解析】
(1)在Ba(OH)2溶液中,Ba2+和OH-的物质的量之比为1:2,故n(OH-)=2n(Ba2+)=2×10-3mol;pH=3的盐酸中c(H+)=10-3mol/L,设盐酸溶液的体积为V,根据混合后溶液显中性,则n(OH-)=n(H+),即2×10-3mol =10-3mol/L×V,解得V=2L=2000mL,故应取氢氧化钡溶液和盐酸的体积之比是200mL:2000mL=1:10;
(2)25℃时,利用pH试纸测得0.1molL-1醋酸溶液的pH约为3,弱电解质存在电离平衡,CH3COOHCH3COO-+H+,常数Ka=![]() ,醋酸溶液的pH约为3,氢离子和醋酸根离子浓度为10-3mol/L,溶液中醋酸溶质浓度近似为0.1mol/L,则可以估算出醋酸的电离常数约为
,醋酸溶液的pH约为3,氢离子和醋酸根离子浓度为10-3mol/L,溶液中醋酸溶质浓度近似为0.1mol/L,则可以估算出醋酸的电离常数约为![]() =10-5mol/L,向10mL此溶液中加入少量冰醋酸,溶解后醋酸溶液浓度增大,醋酸电离程度减小,
=10-5mol/L,向10mL此溶液中加入少量冰醋酸,溶解后醋酸溶液浓度增大,醋酸电离程度减小,![]() 比值减小;
比值减小;
(3) 根据氢离子移动方向可知,通入氢气端为阳极,通入氮气端为阴极,阴极上氮气得到电子生成氨气,电极反应式为N2+6H++6e- = 2NH3;
(4)①N失去电子,Cl得到电子,设消耗0.3molL-1的NaClO溶液为xL,由电子守恒可知,0.3mol×xL×2=![]() ×2×3,解得x=0.3;
×2×3,解得x=0.3;
②由图可知,第一步热化学反应为NH4+ (aq)+1.5O2(g)=2H+(aq)+NO2- (aq)+H2O(l)△H=-273 kJmol-1①,第二步热化学反应为NO2- (aq)+0.5O2(g)=NO3- (aq)△H=-73kJmol-1②,由盖斯定律可知①+②得1mol NH4+(aq)全部氧化成NO3- (aq)的热化学方程式为NH4+ (aq)+2O2(g)=2H+(aq)+NO3- (aq)+H2O(l)△H=-346 kJmol-1,即放出346kJ的热量;
③H2催化还原饮用水中NO3-,反应中的还原产物和氧化产物均可参与大气循环,则产物为水和氮气,该反应为5H2+2NO3-![]() N2+4H2O+2OH-,氢氧根离子浓度增大,则pH升高;
N2+4H2O+2OH-,氢氧根离子浓度增大,则pH升高;
(5)若某次捕捉后得到pH=10 的溶液,则溶液酸碱性主要决定CO32-+ H2O ![]() HCO3-+ OH-,K=
HCO3-+ OH-,K=![]() ,c(CO32-)∶c(HCO3-)=
,c(CO32-)∶c(HCO3-)=![]() 。
。


 课课练江苏系列答案
课课练江苏系列答案 名牌中学课时作业系列答案
名牌中学课时作业系列答案 明天教育课时特训系列答案
明天教育课时特训系列答案 浙江新课程三维目标测评课时特训系列答案
浙江新课程三维目标测评课时特训系列答案科目:高中化学 来源: 题型:
【题目】乙醇分子结构中,各化学键如图所示。关于乙醇在各种反应中断键的说法不正确的是( )
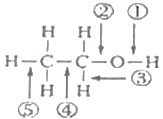
A. 和浓硫酸共热至170℃时,②、⑤键断裂 B. 和金属钠反应时,①键断裂
C. 在银催化条件下与O2反应时,①、③键断裂 D. 乙醇燃烧时,②、④键渐裂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列选项中,属于动、植物细胞共有的糖类是
A. 糖原、淀粉、纤维素 B. 葡萄糖、淀粉、乳糖
C. 蔗糖、麦芽糖、淀粉 D. 葡萄糖、核糖、脱氧核糖
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某无色废水中可能含有NH4+、Fe3+、Al3+、Na+、NO3-、CO32-、SO42-中的几种,为分析其成分,进行了如下三组实验:
①取溶液做焰色反应,火焰为黄色
②取废水样品l00mL,依次加足量的BaCl2溶液和稀HC1,得白色沉淀23.3g
③另取废水样品l00mL向其中加入Na2O2固体,产生的沉淀和气体与所加Na2O2固体物质的量的关系曲线如图

请回答下列问题:
(1)根据上述3组实验可以分析废水中一定不存在的离子有:________________。
(2)写出图象中沉淀溶解阶段发生的离子反应方程式:_________________、____________________。
(3)根据图象分析可知,在原溶液中一定存在的阳离子及其物质的量比值为____________。
(4) NO3-是否存在?_____________; (填“存在‘不存在”或“不确定”)若存在其物质的量浓度为_________________。(若不存在或不确定,该空不填)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】1869年俄国化学家门捷列夫制出第一张元素周期表,到现在形成的周期表经过了众多化学家的艰辛努力,历经142年。元素周期表体现了元素位构性的关系,揭示了元素间的内在联系。如图是元素周期表的一部分,回答下列问题:
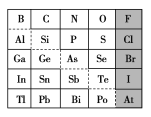
(1)元素Ga在元素周期表中的位置为:第________周期第________族。
(2)Sn的最高正价为________,Cl的最高价氧化物对应水化物的化学式为________,Bi的最高价氧化物为________。
(3)根据元素周期律,推断:
①阴影部分元素氢化物热稳定性最高的是________元素(填元素符号)。
②H3AsO4、H2SeO4的酸性强弱:H3AsO4________(填“>”“<”或“=”)H2SeO4。
③氢化物的还原性:H2O________(填“>”“<”或“=”)H2S。
④原子半径比较:N________(填“>”“<”或“=”)Si。
(4)可在图中分界线(虚线部分)附近寻找________(填序号)。
A.优良的催化剂 B.半导体材料 C.合金材料 D.农药
(5)从下列试剂中选择最佳试剂组合,比较C、Si的非金属性强弱__________________________
(可供选择的药品有:CaCO3固体、稀硫酸、盐酸、饱和NaHCO3溶液、饱和Na2CO3溶液、硅酸钠溶液.)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各种变化中,不属于化学变化的是
A. 电解熔融氧化铝的过程
B. 加热胆矾得到白色的无水硫酸铜粉末
C. 向沸水中滴入饱和氯化铁溶液,制取氢氧化铁胶体
D. .向蛋清溶液中滴入饱和硫酸钠溶液,盐析出白色沉淀
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com