
【题目】下列关于有机化合物的说法正确的是
A. (CH3)2C=CH2的名称为2-甲基-1-丁烯
B. 丙烷的二氯代物有4种同分异构体
C. 苯分子的碳碳双键可与氢气发生加成反应
D. 环已烷分子中所有原子在一个平面内
科目:高中化学 来源: 题型:
【题目】X、Y、Z、W、R是周期表前四周期的五种元素,原子序数依次增大。X原子p轨道上有两个未成对电子;Y的气态氢化物能使石蕊试液变蓝色;Z的最外层电子数为其内层电子数的3倍;W的价电子排布式为ns(n-1)np2(n-1);R的最外层只有1个电子,次外层有18个电子。
(1)X、Y、Z、W四种元素中电负性最大的是__________(填元素符号),基态R原子的核外电子排布式为______________。
(2)X、Y、Z的最简单氢化物中,键角由大到小的顺序为_______________(用氢化物的化学式表示)。
(3)Z、W元素构成的微粒WZ42-的立体构型是________,与WZ42-互为等电子体的一种分子为____(填化学式,任写一种)。
(4)每个XY-离子中含有________个π键。
(5)已知Z、R能形成一种化合物R2Z,其晶胞结构如图所示。

①该晶胞原子坐标参数A为(0,0,0);B为(1,0,0);C为(![]() ,
, ![]() ,
, ![]() )。则D原子的坐标参数为________,它代表_______(填元素符号)原子。
)。则D原子的坐标参数为________,它代表_______(填元素符号)原子。
②若R2Z晶体密度dg·cm-3,晶胞参数为apm,则阿伏伽德罗常数值NA=______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组物质融化或升华时,所克服的粒子间作用力属于同种类型的是
A.Na2O2和SiO2融化 B.Mg和S融化 C.氯化钠和蔗糖融化 D.碘和干冰升华
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA表示阿伏伽徳罗常数的数值,下列说法中正确的是
A. lmolNa2O和Na2O2混合物中含有的阴阳离子总数大于3NA
B. 常温常压下,20gD2O分子中所含中子数为10NA
C. 50ml12mol·L-1的盐酸与足量的MnO2共热转移的电子数为0.3 NA
D. 密闭容器中2mol NO和Imol的O2,充分反应,产物的分子数为2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高温下超氧化钾晶体呈立方体结构,晶体中氧的化合价部分为0价,部分为-2价。如右图所示为超氧化钾晶体的一个晶胞(晶体中最小的重复单元),则下列说法中正确的是

A.超氧化钾的化学式为KO2,每个晶胞含有4个K+和4个O2-
B.晶体中每个K+周围有8个O2-,每个O周围有8个K+
C.晶体中与每个K+距离最近的K+有8个
D.晶体中,0价氧与-2价氧的数目比为2:1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示的两个实验装置中,溶液的体积均为200mL,开始时电解质溶液的浓度均为0.1mol/L,工作一段时间后,测得导线上均通过0.02mol电子,若不考虑溶液体积的变化,则下列叙述中正确的是( )
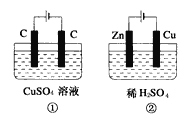
A. 产生气体的体积:(1)>(2)
B. 溶液PH的变化:(1)增大,(2)减小
C. 电极上析出物质的质量:(1)>(2)
D. 电极反应式:(1)中阳极:40H--4e-=2H2O+O2↑(2)中负极:2H++2e-=H2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在密闭容器内充入4 mol S02和3mol 02,在一定条件下建立平衡:
2SO2(g)+02(g)![]() 2SO3(g) △H="-Q" kJ·mol-1(Q>0),测得SO2的转化率为90%,
2SO3(g) △H="-Q" kJ·mol-1(Q>0),测得SO2的转化率为90%,
则在此条件下反应放出的热量为( )
A. 1.8Q kJ B. 2Q kJ C. Q kJ D. 0.9 QJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向某溶液中加入含Fe2+的溶液后,无明显变化。当再滴入新制氯水后,混合溶液变成红色,则下列结论错误的是( )
A. 该溶液中一定含有SCN- B. 氧化性:Fe3+>Cl2
C. Fe2+与SCN-不能形成红色物质 D. Fe2+被氧化为Fe3+
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com