
【题目】下列反应方程式不正确的是
A.氯气与水反应的离子方程式:Cl2+H2O![]() HClO+H++Cl-
HClO+H++Cl-
B.制备硝基苯的化学方程式:![]() +HO-NO2
+HO-NO2![]()
![]() NO2+H2O
NO2+H2O
C.碳酸钾水解的离子方程式:CO32-+2H2O=H2CO3+2OH-
D.钠与水反应的离子方程式:2Na+2H2O=2Na++2OH-+H2↑
【答案】C
【解析】
A.Cl2与H2O反应产生HCl和HClO,HCl是强酸,完全电离,HClO是弱酸,主要以分子存在,该反应是可逆反应,故反应的离子方程式应该为:Cl2+H2O![]() HClO+H++Cl-,A正确;
HClO+H++Cl-,A正确;
B.苯与浓硝酸、浓硫酸混合加热发生取代反应产生硝基苯和水,反应的化学方程式为:![]() +HO-NO2
+HO-NO2![]()
![]() NO2+H2O,B正确;
NO2+H2O,B正确;
C.碳酸钠电离产生的CO32-水解分步进行,主要是第一步水解产生HCO3-,且水解反应是可逆反应,故水解方程式应该为:CO32-+H2O![]() HCO3-+OH-,C错误;
HCO3-+OH-,C错误;
D.钠与水反应产生NaOH和H2,根据电子守恒、电荷守恒及原子守恒,可得该反应的离子方程式:2Na+2H2O=2Na++2OH-+H2↑,D正确;
故合理选项是C。


科目:高中化学 来源: 题型:
【题目】2SO2(g)+O2(g)![]() 2SO3(g) △H=-198kJ/mol,在V2O5存在时,该反应机理为:V2O5+SO2→2VO2+SO3(快); 4VO2+O2→2V2O5(慢),下列说法正确的是( )
2SO3(g) △H=-198kJ/mol,在V2O5存在时,该反应机理为:V2O5+SO2→2VO2+SO3(快); 4VO2+O2→2V2O5(慢),下列说法正确的是( )
A.反应速率主要取决于V2O5的质量B.VO2是该反应的催化剂
C.该反应逆反应的活化能大于198kJ/molD.升高温度,该反应的△H增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验操作、实验现象和实验结论均正确的是( )
选项 | 实验操作 | 实验现象 | 实验结论 |
A | 将Al2(SO4)3溶液和NaHCO3溶液混合 | 产生白色沉淀,并有大量气体生成 | 生成Al2(CO3)3沉淀和CO2气体 |
B | 在淀粉溶液中加入几滴稀硫酸,水浴5min,加入NaOH溶液调溶液pH至碱性,再加入新制的Cu(OH)2悬浊液,加热 | 有红色沉淀生成 | 淀粉完全水解 |
C | 将少量SO2气体通过足量Na2O2 | 余下气体能使带火星木条复燃 | 有O2生成 |
D | 用pH试纸分别测定等浓度的A、B两溶液(可能为NaHCO3或者Na2CO3)的pH值 | pHA> pHB | A溶液为Na2CO3溶液 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于反应热的叙述正确的是( )
A.当ΔH<0时,表示该反应为吸热反应
B.由C(s)+![]() O2(g)=CO(g)的反应热为110.5kJ·mol-1,可知碳的燃烧热为110.5kJ·mol-1
O2(g)=CO(g)的反应热为110.5kJ·mol-1,可知碳的燃烧热为110.5kJ·mol-1
C.反应热的大小与反应物所具有的能量和生成物所具有的能量无关
D.1molNaOH分别和1molCH3COOH、1molHNO3反应放出的热量:CH3COOH<HNO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下面有关晶体的叙述中,正确的是( )
A.在晶体中只要有阳离子就一定有阴离子
B.离子晶体中只有离子键没有共价键,分子晶体中只有分子间作用力没有共价键
C.分子晶体中分子间作用力越大,分子越稳定
D.原子晶体中原子以共价键结合,具有键能大、熔点高、硬度大的特性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,在2 L恒容密闭容器中投入一定量的A、B,发生反应:3A(g)+bB(g)![]() cC(g)+2D(s),12 s时生成C的物质的量为0.8 mol(反应进程如图所示)。下列说法中正确的是
cC(g)+2D(s),12 s时生成C的物质的量为0.8 mol(反应进程如图所示)。下列说法中正确的是

A.图中两曲线相交时,A的消耗速率等于A的生成速率
B.0-2 s,D的平均反应速率为0.1 mol·L-1·s-1
C.化学计量系数之比b:c=1:4
D.12 s时,A的转化率为75%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】麻黄素M是拟交感神经药。合成M的一种路线如图所示:
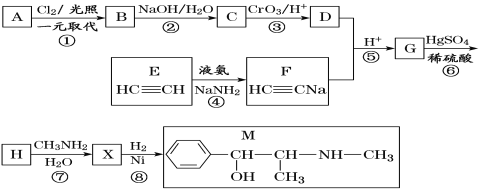
已知:I.R—CH2OH![]() RCHO
RCHO
II.R1-CHO+R-C≡CNa![]()
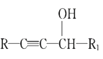
IV.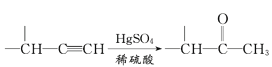
V.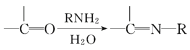
请回答下列问题:
(1)D的名称是_______;G中含氧官能团的名称是_______。
(2)反应②的反应类型为_______;A的结构简式为_______。
(3)写出反应⑦的化学方程式:______________________________。
(4)X分子中最多有_______个碳原子共平面。
(5)在H的同分异构体中,同时能发生水解反应和银镜反应的芳香族化合物中,核磁共振氢谱上有4组峰,且峰面积之比为1∶1∶2∶6的有机物的结构简式为_________________。
(6)已知:![]() 仿照上述流程,设计以苯、乙醛为主要原料合成某药物中间体
仿照上述流程,设计以苯、乙醛为主要原料合成某药物中间体![]() 的路线________________。
的路线________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下三氯化氮( NCl3)是一种淡黄色液体,其分子结构呈三角锥形,以下关于NCl3的说法正确的是
A.分子中N—Cl键是非极性键
B.分子中不存在孤电子对
C.NCl3分子是极性分子
D.因N—Cl键的键能大,它的沸点高
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】砷(As)是一些工厂和矿山废水中的污染元素,使用吸附剂是去除水中砷的有效措施之一。
(1)将硫酸锰、硝酸钇与氢氧化钠溶液按一定比例混合,搅拌使其充分反应,可获得一种砷的高效吸附剂X,吸附剂X中含有CO32-,其原因是____。
(2)H3AsO3和H3AsO4水溶液中含砷的各物种的分布分数(平衡时某物种的浓度占各物种浓度之和的分数)与pH的关系分别如图1和图2所示。


①以酚酞为指示剂(变色范围pH8.0~10.0),将NaOH溶液逐滴加入H3AsO3溶液中,当溶液由无色变为浅红色时停止滴加。该过程中主要反应的离子方程式为____。
②H3AsO4第一步电离方程式H3AsO4![]() H2AsO4-+H+的电离常数为Ka1,则pKa1=___(pKa1=-lgKa1)。
H2AsO4-+H+的电离常数为Ka1,则pKa1=___(pKa1=-lgKa1)。
(3)溶液的pH对吸附剂X表面所带电荷有影响。pH=7.1时,吸附剂X表面不带电荷;pH>7.1时带负电荷,pH越高,表面所带负电荷越多;pH<7.1时带正电荷,pH越低,表面所带正电荷越多。pH不同时吸附剂X对三价砷和五价砷的平衡吸附量(吸附达平衡时单位质量吸附剂X吸附砷的质量)如图3所示。

①在pH7~9之间,吸附剂X对五价砷的平衡吸附量随pH升高而迅速下降,其原因是___。
②吸附剂X对水中三价砷的去除能力远比五价砷的弱,这是因为___,提高吸附剂X对三价砷去除效果可采取的措施是___。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com