
【题目】某温度下,在2 L恒容密闭容器中投入一定量的A、B,发生反应:3A(g)+bB(g)![]() cC(g)+2D(s),12 s时生成C的物质的量为0.8 mol(反应进程如图所示)。下列说法中正确的是
cC(g)+2D(s),12 s时生成C的物质的量为0.8 mol(反应进程如图所示)。下列说法中正确的是

A.图中两曲线相交时,A的消耗速率等于A的生成速率
B.0-2 s,D的平均反应速率为0.1 mol·L-1·s-1
C.化学计量系数之比b:c=1:4
D.12 s时,A的转化率为75%
【答案】D
【解析】
A.交点时,随时间变化A的浓度发生变化,反应未达到平衡状态,故A的消耗速率不等于A的生成速率,A错误;
B.D是固体物质,浓度不变,因此不能使用固体物质表示反应速率,B错误;
C.根据图象可知,12 s时反应达到平衡,A的浓度变化△c(A)=0.8 mol/L-0.2 mol/L=0.6 mol/L,B的浓度变化△c(B)=0.5 mol/L-0.3 mol/L=0.2 mol/L,C的物质的量浓度变化△c(C)=0.8 mol÷2 L=0.4 mol/L, 它们反应时变化的物质的量浓度比等于化学方程式中化学计量数之比,3:b:c=0.6:0.2:0.4,解得:b=1,c=2,化学计量数之比b:c=1:2,C错误;
D.12 s内△c(A)=0.8 mol/L-0.2 mol/L=0.6 mol/L,所以A的转化率为![]() ×100%=75%,D正确;
×100%=75%,D正确;
故合理选项是D。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】不同温度下,三个体积均为1L的密闭容器中发生反应:CH4(g)+2NO2(g)![]() N2(g)+CO2(g)+2H2O(g) △H=-867 kJ.mol-1,实验测得起始、平衡时的有关数据如表。下列说法正确的是
N2(g)+CO2(g)+2H2O(g) △H=-867 kJ.mol-1,实验测得起始、平衡时的有关数据如表。下列说法正确的是
容器编号 | 温度/K | 起始物质的量/mol | 平衡物质的量/mol | ||||
CH4 | NO2 | N2 | CO2 | H2O | NO2 | ||
I | T1 | 0.50 | 1.2 | 0 | 0 | 0 | 0.40 |
II | T2 | 0.30 | 0.80 | 0.20 | 0.20 | 0.40 | 0.60 |
III | T3 | 0.40 | 0.70 | 0.70 | 0.70 | 1.0 | |
A.T1<T2
B.若升高温度,正反应速率减小,逆反应速率增大,平衡逆移
C.平衡时,容器I中反应放出的热量为693.6 kJ
D.容器III中反应起始时v 正(CH4) <v逆(CH4)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关同分异构体数目的判断,正确的是
A.丁烷(C4H10)的二氯代物有10种
B.分子式为C4H8的烯烃包括顺反异构体共5种
C.萘(![]() )环上一个氢原子被丁基(-C4H9)所取代的同分异构体(不考虑立体异构)有8种
)环上一个氢原子被丁基(-C4H9)所取代的同分异构体(不考虑立体异构)有8种
D.分子式为C5H12O的醇有4种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】分别用浓度均为![]() 的
的![]() 和NaOH溶液,滴定
和NaOH溶液,滴定![]() 溶液,随滴定溶液体积的增大,溶液的导电能力变化曲线如图所示,下列说法中正确的是
溶液,随滴定溶液体积的增大,溶液的导电能力变化曲线如图所示,下列说法中正确的是![]()
![]()
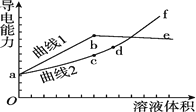
A.曲线2代表滴加![]() 溶液的变化曲线
溶液的变化曲线
B.b和d点对应的溶液均显碱性
C.b点溶液中![]()
D.![]() 段导电能力升高的原因是发生了反应
段导电能力升高的原因是发生了反应![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应方程式不正确的是
A.氯气与水反应的离子方程式:Cl2+H2O![]() HClO+H++Cl-
HClO+H++Cl-
B.制备硝基苯的化学方程式:![]() +HO-NO2
+HO-NO2![]()
![]() NO2+H2O
NO2+H2O
C.碳酸钾水解的离子方程式:CO32-+2H2O=H2CO3+2OH-
D.钠与水反应的离子方程式:2Na+2H2O=2Na++2OH-+H2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、R为前四周期元素,原子序数依次增大。X、Y同周期,X基态原子的最外层电子数是次外层的2倍,Y基态原子的s能级和p能级上电子数相等;Z是地壳中含量最高的金属元素;R+离子的3d轨道全充满。请回答下列问题:
(1)Z3+离子的核外电子排布式是_______。
(2)科学家成功地在高压下将XY2转化为具有类似SiO2结构的原子晶体,该晶体中X原子的杂化轨道类型是_______;X、Z、R的单质分别与足量Y2充分反应所得产物的熔点由高到低的顺序是_______。(填化学式)
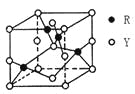
(3)由Y、R形成的某化合物的晶胞结构如图所示,其化学式是_______。
(4)常温下,pH相同的NaZY2与Na2XY3两种溶液,物质的量浓度较大的是_______。(填化学式)
(5)将亚硫酸钠的水溶液逐滴加入RCl2的水溶液中,再加入少量浓盐酸混匀,得到难溶的白色沉淀RCl,该反应的离子方程式是_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验装置能达到实验目的是(夹持仪器未画出)
A.  用于检验溴乙烷消去生成的乙烯
用于检验溴乙烷消去生成的乙烯
B.  用于石油的分馏
用于石油的分馏
C.  用于实验室制硝基苯
用于实验室制硝基苯
D.  可证明酸性:盐酸>碳酸>苯酚
可证明酸性:盐酸>碳酸>苯酚
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碳族元素包括:C,Si, Ge, Sn,Pb。
(1)碳纳米管有单层或多层石墨层卷曲而成,其结构类似于石墨晶体,每个碳原子通过____杂化与周围碳原子成键,多层碳纳米管的层与层之间靠____结合在一起。
(2)用价层电子对互斥理论推断SnBr2分子中Sn—Br的键角___120°(填“>”“<”或“=”)。
(3)铅,钡,氧形成的某化合物的晶胞结构是:Pb4+处于立方晶胞顶点,Ba2+处于晶胞中心,O2-处于晶胞棱边中心,该化合物化学式为_______,每个Ba2+与____个O2-配位。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二氧化氯(ClO2)是一种高效消毒剂,易溶于水,沸点为11.0℃,极易爆炸分解,若用空气、二氧化碳、氮气等惰性气体稀释时,爆炸性则降低。用干燥的氯气与固体亚氯酸钠制备二氧化氯,装置如图:

(1)仪器a的名称为___________,装置A中反应的离子方程式为____________________。
(2)试剂X的作用是_____________________________。
(3)装置D中通入干燥空气的作用是______________________________。
(4)该实验装置的缺陷是_____________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com