
����Ŀ����̼�������Ե��ܺġ�����Ⱦ�����ŷ�Ϊ�����ľ���ģʽ����̼���õĸ������й���Ѹ�ٴӸ߶˸����ݱ��ȫ������Ϊ��������Դ��������ҵ���ܵȶ����������Ϊ�������û�ѧ��Ӧԭ�������֪ʶ�о�̼���仯���������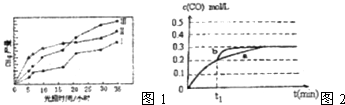
��1��ʵ�����ﳣ��NaOH��Һ����CO2 �� ����100mL 3molL��1��NaOH��Һ����4.48L����״���£�CO2 �� ��ȫ���շ�Ӧ��������Һ������Ũ���ɴ�С��˳��Ϊ
��2����ҵ�Ͽ�����CO��CO2���Ʊ����Һ��ȼ�ϼ״�����֪��800��ʱ����ѧ��Ӧ�١���Ӧ�ڶ�Ӧ��ƽ�ⳣ���ֱ�Ϊ2.5��1.0��Ӧ�٣�2H2��g��+CO��g��CH3OH��g����H=��90.8kJmol��1
��Ӧ�ڣ�H2��g��+CO2��g��H2O��g��+CO��g����H=+41.2kJmol��1
д����CO2��H2��Ӧ�Ʊ��״����Ȼ�ѧ����ʽ �� 800��ʱ�÷�Ӧ�Ļ�ѧƽ�ⳣ��K����ֵΪ
��3�����ù��ܺ�������ɽ�CO2��H2O��g��ת��ΪCH4��O2 �� ����������ʱ���ڲ�ͬ�������������£�CH4���������ʱ��ı仯��ͼ1��ʾ����0��15h�ڣ��Է�Ӧ��Ч����õĴ�����������ţ�
��4��һ���¶��£���3L�ݻ��ɱ���ܱ������з���������Ӧ�ڣ���֪c��CO���淴Ӧʱ��t�ı仯����a��ͼ2��ʾ����t1ʱ�̸ı�һ������������a��Ϊb����ı�������� �� ����t1ʱ�̣����������3L����ѹ����2L����ͼ�ϻ����仯����
��5�������仯�����ڹ�ҵ�����Ź㷺��Ӧ�ã��ڵؿ��г��������ε���ʽ���ڣ�BaSO4���������Σ���ҵ����ȡ��ʱ������Na2CO3��Һ��BaSO4ת�������������Σ�BaCO3������д����BaSO4ת����BaCO3�����ӷ���ʽ�÷�Ӧ��ƽ�ⳣ��Ϊ����������֣�����֪Ksp��BaSO4��=1.1��10��10mol2L��2 �� Ksp��BaCO3��=2.5��10��9mol2L��2
���𰸡�
��1��c��Na+����c��HCO3������c��CO32������c��OH������c��H+��
��2��CO2��g��+3H2��g��?CH3OH��g��+H2O��l����H=��49.6kJ/mol��2.5
��3����
��4�����������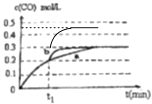
��5��BaSO4��s��+CO32����aq��=BaCO3��s��+SO42����aq����0.044
���������⣺��1��CO2���ʵ���Ϊ ![]() =0.2mol��NaOH���ʵ���Ϊ0.1L��3mol/L=0.3mol������1��n��NaOH����n��CO2��=3��2��2��������Ӧ��2CO2+3NaOH=Na2CO3+NaHCO3+H2O��Na2CO3��NaHCO3�����ʵ�����ȣ�̼������Ӻ�̼���������ˮ���ʹ��Һ�ʼ��ԣ���c��OH������c��H+����̼�������ˮ������̼��������ӣ�����c��HCO3������c��CO32����������ˮ��̶Ƚ�С������c��CO32������c��OH����������Һ�и�����Ũ�ȴ�С˳����c��Na+����c��HCO3������c��CO32������c��OH������c��H+���� ���Դ��ǣ�c��Na+����c��HCO3������c��CO32������c��OH������c��H+������2����Ӧ�٣�2H2��g��+CO��g��CH3OH��g����H=��90.8kJmol��1,��Ӧ�ڣ�H2��g��+CO2��g��H2O��g��+CO��g����H=+41.2kJmol��1,���ݸ�˹���ɣ���+�ڿɵã�CO2��g��+3H2��g��CH3OH��g��+H2O��l����H=��49.6kJ/mol���÷�Ӧ�Ļ�ѧƽ�ⳣ��K=
=0.2mol��NaOH���ʵ���Ϊ0.1L��3mol/L=0.3mol������1��n��NaOH����n��CO2��=3��2��2��������Ӧ��2CO2+3NaOH=Na2CO3+NaHCO3+H2O��Na2CO3��NaHCO3�����ʵ�����ȣ�̼������Ӻ�̼���������ˮ���ʹ��Һ�ʼ��ԣ���c��OH������c��H+����̼�������ˮ������̼��������ӣ�����c��HCO3������c��CO32����������ˮ��̶Ƚ�С������c��CO32������c��OH����������Һ�и�����Ũ�ȴ�С˳����c��Na+����c��HCO3������c��CO32������c��OH������c��H+���� ���Դ��ǣ�c��Na+����c��HCO3������c��CO32������c��OH������c��H+������2����Ӧ�٣�2H2��g��+CO��g��CH3OH��g����H=��90.8kJmol��1,��Ӧ�ڣ�H2��g��+CO2��g��H2O��g��+CO��g����H=+41.2kJmol��1,���ݸ�˹���ɣ���+�ڿɵã�CO2��g��+3H2��g��CH3OH��g��+H2O��l����H=��49.6kJ/mol���÷�Ӧ�Ļ�ѧƽ�ⳣ��K= ![]() =
= ![]() ��
�� ![]() =2.5��1=2.5�����Դ��ǣ�CO2��g��+3H2��g��CH3OH��g��+H2O��l����H=��49.6kJ/mol��2.5����3����ͼ��֪����0��15h�ڣ�����������ͬʱ����CH4�����ߣ��Է�Ӧ��Ч����õĴ����Ǣ�
=2.5��1=2.5�����Դ��ǣ�CO2��g��+3H2��g��CH3OH��g��+H2O��l����H=��49.6kJ/mol��2.5����3����ͼ��֪����0��15h�ڣ�����������ͬʱ����CH4�����ߣ��Է�Ӧ��Ч����õĴ����Ǣ�
���Դ��ǣ���4����t1ʱ�̸ı�һ������������a��Ϊb�����̵���ƽ���ʱ�䣬��Ӧ���ʼӿ죬ƽ��ʱCO��Ũ�Ȳ��䣬�ı䲻Ӱ��ƽ���ƶ����������������¶ȣ���Ӧ���Ƿ�Ӧǰ����������ʵ�������ķ�Ӧ������ѹǿƽ�ⲻ�ƶ�����CO��Ũ�Ȼ������ܸı�������Ǽ������������t1ʱ�̣����������3L����ѹ����2L��ѹǿ����Ӧ���ʼӿ죬���̵���ƽ���ʱ�䣬��Ӱ��ƽ���ƶ���ƽ��ʱCO��Ũ�ȱ�Ϊ ![]() =0.45mol/L����t1ʱ��˲��CO��Ũ��Ϊ0.3mol/L�������仯����Ϊ��
=0.45mol/L����t1ʱ��˲��CO��Ũ��Ϊ0.3mol/L�������仯����Ϊ��  ��
��
���Դ��ǣ����������  ����5����BaSO4ת����BaCO3�����ӷ���ʽ��BaSO4��s��+CO32����aq��=BaCO3��s��+SO42����aq�����÷�Ӧ��ƽ�ⳣ��K=
����5����BaSO4ת����BaCO3�����ӷ���ʽ��BaSO4��s��+CO32����aq��=BaCO3��s��+SO42����aq�����÷�Ӧ��ƽ�ⳣ��K= 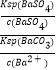 =
= ![]() =
= ![]() =0.044�����Դ��ǣ�BaSO4��s��+CO32����aq��=BaCO3��s��+SO42����aq����0.044��
=0.044�����Դ��ǣ�BaSO4��s��+CO32����aq��=BaCO3��s��+SO42����aq����0.044��
�����㾫�����������⣬������Ҫ�˽⻯ѧƽ��״̬���ʼ�����(��ѧƽ��״̬�����������ȡ��� V��=V��>0�����������Ƕ�̬ƽ�⣬ƽ��ʱ��Ӧ���ڽ��У�����������Ӧ������и���ְٷֺ������䣻���䡱�������ı䣬ƽ�ⱻ���ƣ������µ������½����µĻ�ѧƽ�⣻��;���أ�����������䣬���淴Ӧ�����Ǵ�����Ӧ��ʼ�����Ǵ��淴Ӧ��ʼ�����ɽ���ͬһƽ��״̬����Ч��)����Ҫ���ջ�ѧƽ��ļ���(��Ӧ��ת����=ת��Ũ�ȡ���ʼŨ�ȡ�100%=ת�����ʵ�������ʼ���ʵ�����100%����Ʒ�IJ���=ʵ�����ɲ�������ʵ����������Ͽɵõ���������ʵ�����100%)�����֪ʶ���Ǵ���Ĺؼ���



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����������һ�����Ϳɳ���أ�����ͨ���ܵ����ȣ��õ���ܳ�ʱ�䱣���ȶ��ķŵ��ѹ��������ص��ܷ�ӦΪ��3Zn+2K2FeO4+8H��1O ![]() 3Zn��OH��2+2Fe��OH��3+4KOH��������������ȷ���ǣ� ��
3Zn��OH��2+2Fe��OH��3+4KOH��������������ȷ���ǣ� ��
A.�ŵ�ʱÿת��3mol���ӣ�������1mol K2FeO4������
B.���ʱ������ӦΪ��Fe��OH��3��3e��+5 OH���TFeO ![]() +4H2O
+4H2O
C.�ŵ�ʱ����������Һ�ļ�����ǿ
D.�ŵ�ʱ������ӦΪ��Zn��2e��+2OH���TZn��OH��2
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵����ȷ����
A.���ۡ���ά�ؼ���ˮ��������������
B.��Ȼֲ���ͳ�����һ���Һ̬��������ˮ���к㶨���۵㡢�е�
C.��������Һ�м�����炙��Ȼ�ͭ��Һ�����ᷢ�������ʵı���
D.���ࡢ��֬�������ʾ��ܷ���ˮ�ⷴӦ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������٤������ԼΪ6.02��1023mol��1 �� ������������ȷ���ǣ� ��
A.��״���£�4.48LCH3CH2OH��Լ����1.204��1023���ǻ�
B.���³�ѹ�£�31g����P4�ͺ���P8�Ļ����Լ����6.02��1023����ԭ��
C.��״���£�7.8g����Լ����1.806��1023��̼̼˫��
D.1molH2O2��MnO2����������ȫ��Ӧת�Ƶĵ�����ԼΪ1.204��1024������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������CH4��CH2=CH2��CH��CH�����������(����)
A.�ֱ�ͨ����ˮ
B.�ֱ�ͨ�����Ը��������Һ
C.�ֱ��ڿ����е�ȼ
D.�ֱ�ͨ��ʢ�м�ʯ�ҵĸ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������ȣ�SO2Cl2���������Ȼ������Ȼǻ������緼���廯������Ȼ���������Ȼ������������л�������������Ȼ���Ҳ��������ҩƷ��ȼ�ϡ�������Լ��ȣ�������ͨ��������Ϊ��ɫҺ�壬�۵�Ϊ��54.1�棬�е�Ϊ69.1�棬�ڳ�ʪ�������ס����̡���100�����ϱ㿪ʼ�ֽ�Ϊ�����������������ҵ�ϳ������������ϳ������ȣ�������Ķ��������������һ�������½��з�Ӧ���䷴Ӧԭ����ʵ��װ�����£�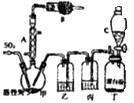
SO2��g��+Cl2��g�� ![]() SO2Cl2��l����H=��97.3kJmol��1 ��ش��������⣺
SO2Cl2��l����H=��97.3kJmol��1 ��ش��������⣺
��1������A��������
��2�������B��ʢ�ŵ�ҩƷ�� �� ������
��3��ʵ��ʱ������C�зų�Һ��IJ���������
��4��װ������ʢ�ŵ�����Ϊ �� ��ȱ��װ���ң���ʵ������ʲôӰ�죿
��5���Ȼ��ᣨClSO3H����һ����ɫ�ķ���Һ�壬�д̼��Գ�ζ���е�178�棬���ȷֽ�Ҳ���Ƶ������ȣ�ͬʱ��������һ���������ɣ��÷�Ӧ�Ļ�ѧ����ʽΪ �� �������ķ�����
A���ؽᾧ B������ C������ D����ȡ
��6��Ϊ��߱�ʵ���������ȵIJ��ʣ���ʵ���������Ҫע���������������ţ�
A.���������ٶȣ��������˿�
B.ˮԡ����������ƿ
C.��������ƿ���̣����ʵ����£�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ϩ��һ��ʳ�����ϣ���ṹ��ʽΪ�� ![]() �й�����ϩ�ķ�����ȷ���ǣ� ��
�й�����ϩ�ķ�����ȷ���ǣ� ��
A.����ʽΪC10H14
B.һ�������£�����ϩ���Է����ӳɡ�ȡ������������ԭ��Ӧ
C.����ϩ�����ڱ���ͬϵ���ͬ���칹��
D.����ϩ�ķ���������̼ԭ�ӿ��ܴ���ͬһ��ƽ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ø�˹���ɿɼ���һЩ���ײⶨ�ķ�Ӧ�ķ�Ӧ�ȣ�
��1����֪��298Kʱ������Ӧ���й����ݣ�C��s��+ ![]() O2��g��=CO��g����H1=��110.5kJmol��1 �� C��s��+O2��g��=CO2��g����H2=��393.5kJmol��1 �� ��C��s��+CO2��g��=2CO��g�� �ġ�HΪ ��
O2��g��=CO��g����H1=��110.5kJmol��1 �� C��s��+O2��g��=CO2��g����H2=��393.5kJmol��1 �� ��C��s��+CO2��g��=2CO��g�� �ġ�HΪ ��
��2���������ʱ�����£�N2H4��Ϊȼ�ϣ��Զ������������������������Ӧ���ɵ�����ˮ��������֪��N2��g��+2O2��g��=2NO2��g����H=+67.7kJmol��l��N2H4��g��+O2��g��=N2��g��+2H2O��g����H=��534kJmol��l �� ��N2H4��NO2��Ӧ���ɵ�����ˮ�������Ȼ�ѧ����ʽΪ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��25��ʱ����1L���ܱ������г���NO2�������·�Ӧ��2NO2��g��N2O4��g������H=��57kJmol��1
��1���÷�Ӧ�ġ�S0�����������������=������
��2������ʼ����0.03mol��NO2ʱ��25��ʱ��ʵ����NO2��ƽ��Ũ��Ϊ0.01molL��1 �� ��NO2��ƽ��ת���ʣ������� �� 25��ʱ������Ӧ��ƽ�ⳣ��K= ��
��3��25��ʱ��ʵ���ø÷�Ӧ�Ļ��Ea=92.4kJmol��1 �� ����������ϵͼ�������� �� 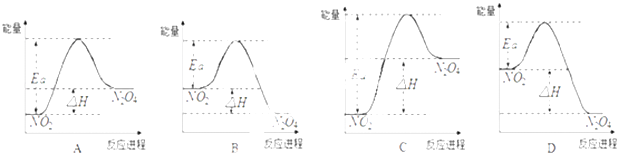
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com