
����Ŀ�������ȣ�SO2Cl2���������Ȼ������Ȼǻ������緼���廯������Ȼ���������Ȼ������������л�������������Ȼ���Ҳ��������ҩƷ��ȼ�ϡ�������Լ��ȣ�������ͨ��������Ϊ��ɫҺ�壬�۵�Ϊ��54.1�棬�е�Ϊ69.1�棬�ڳ�ʪ�������ס����̡���100�����ϱ㿪ʼ�ֽ�Ϊ�����������������ҵ�ϳ������������ϳ������ȣ�������Ķ��������������һ�������½��з�Ӧ���䷴Ӧԭ����ʵ��װ�����£�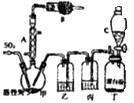
SO2��g��+Cl2��g�� ![]() SO2Cl2��l����H=��97.3kJmol��1 ��ش��������⣺
SO2Cl2��l����H=��97.3kJmol��1 ��ش��������⣺
��1������A��������
��2�������B��ʢ�ŵ�ҩƷ�� �� ������
��3��ʵ��ʱ������C�зų�Һ��IJ���������
��4��װ������ʢ�ŵ�����Ϊ �� ��ȱ��װ���ң���ʵ������ʲôӰ�죿
��5���Ȼ��ᣨClSO3H����һ����ɫ�ķ���Һ�壬�д̼��Գ�ζ���е�178�棬���ȷֽ�Ҳ���Ƶ������ȣ�ͬʱ��������һ���������ɣ��÷�Ӧ�Ļ�ѧ����ʽΪ �� �������ķ�����
A���ؽᾧ B������ C������ D����ȡ
��6��Ϊ��߱�ʵ���������ȵIJ��ʣ���ʵ���������Ҫע���������������ţ�
A.���������ٶȣ��������˿�
B.ˮԡ����������ƿ
C.��������ƿ���̣����ʵ����£�
���𰸡�
��1������������
��2����ʯ�ң�����δ��Ӧ�Ķ��������������Լ������е�ˮ����
��3����Һ©���Ͽڲ�����������ת����ʹҺ������
��4��Ũ��������Ͷ�������ˮ��Ӧ����HCl�����ᣬ�����������ȵIJ���
��5��2C1SO3H ![]() SO2Cl2+H2SO4Z������
SO2Cl2+H2SO4Z������
��6��C
���������⣺��1��������A�Ľṹ��������֪AΪ���������ܣ����Դ��ǣ����������ܣ���2������SO2Cl2�ڳ�ʪ�����С����̡���װ��B�����������տ�����ˮ������������δ��Ӧ�Ķ�����������������ֹ��Ⱦ����������ʢ�ż�ʯ�ң����Դ��ǣ���ʯ�ң�����δ��Ӧ�Ķ��������������Լ������е�ˮ��������3��������C�зų���Һ�IJ��������ǣ���Һ©���Ͽڲ�����������ת����ʹҺ�����£����Դ��ǣ���Һ©���Ͽڲ�����������ת����ʹҺ�����£���4����װ���Ʊ��������к���HCl��ˮ��������װ��ʢ�ű���ʳ��ˮ����ȥ���е�HCl����װ��ʢ��Ũ���ᣬ������������ȱ��װ���ң������Ͷ�������ˮ��Ӧ����HCl�����ᣬ��Ӧ����ʽΪ��Cl2+SO2+2H2O=2HCl+H2SO4���Ӷ������������ȵIJ��������Դ��ǣ�Ũ��������Ͷ�������ˮ��Ӧ����HCl�����ᣬ�����������ȵIJ�������5���Ȼ��ᣨClSO3H�����ȷֽ⣬Ҳ���Ƶ������ȣ�SO2Cl2��������һ�����ʣ���Ԫ���غ��֪���������ʺ���HԪ�أ�ClSO3H��S��Clԭ����Ŀ֮��Ϊ1��1����SO2Cl2��S��Clԭ����Ŀ֮��Ϊ1��2�������������к���SԪ�أ����ԭ���غ��֪��������ΪH2SO4 �� ��Ӧ����ʽΪ��2ClSO3H ![]() SO2Cl2+H2SO4 �� ����Ϊ����Һ�壬�е����ϴ�ȡ�����з��룬���Դ��ǣ�2ClSO3H
SO2Cl2+H2SO4 �� ����Ϊ����Һ�壬�е����ϴ�ȡ�����з��룬���Դ��ǣ�2ClSO3H ![]() SO2Cl2+H2SO4������6��Ϊ��߱�ʵ���������ȵIJ��ʣ����Կ����������٣��������˿죬ʹ���ַ�Ӧ������100������SO2Cl2��ʼ�ֽ⣬�÷�ӦΪ���ȷ�Ӧ�����Զ�������ƿ�����ʵ��Ľ��£����Դ��ǣ�AC��
SO2Cl2+H2SO4������6��Ϊ��߱�ʵ���������ȵIJ��ʣ����Կ����������٣��������˿죬ʹ���ַ�Ӧ������100������SO2Cl2��ʼ�ֽ⣬�÷�ӦΪ���ȷ�Ӧ�����Զ�������ƿ�����ʵ��Ľ��£����Դ��ǣ�AC��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���� 2L �ݻ�������ܱ������ڣ�800��ʱ��Ӧ 2NO��g��+O2��g���T2NO2��g����ϵ�У�n��NO����ʱ��ı仯���±���
t/s | 0 | 1 | 2 | 3 | 4 | 5 |
n��NO��/mol | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |
��1����O2�ķ�Ӧ���ʱ�ʾ 0��2s �ڸ÷�Ӧ��ƽ����Ӧ���� v= �� ��������Ӧ��850���½��У���Ӧ2sʱ n��NO��=0.009mol�����Ҳ�����ʱ����ı䣬��÷�Ӧ���ȷ�Ӧ��
��2��ͼ�б�ʾNO2Ũ�ȱ仯��������������ĸ���� 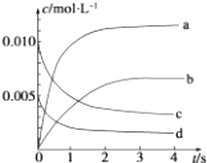
��3����˵���÷�Ӧ�Ѵﵽƽ��״̬����������ţ���
A.v��NO2��=2v��O2��
B.�����ڵ�ѹǿ���ֲ���
C.v����NO��=2v����O2��
D.�����������ܶȱ��ֲ���
��4����ʹ�÷�Ӧ�ķ�Ӧ����������ƽ��������Ӧ�����ƶ�����������ţ���
A.��ʱ�����NO2
B.�ʵ������¶�
C.����O2��Ũ��
D.ѡ���Ч������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������һ�����ʵ���Ũ�ȵ�NaOH��Һʱ�������������ҺŨ��ƫ�͵�ԭ���ǣ� ��
A.����ʱ����Һ��
B.δϴ���ձ��Ͳ�����
C.����ƿδ����
D.ת����Һǰ��Һδ��ȴ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������������Ȳ�Ľṹ�������У��Ȳ�ͬ����ϩ��Ҳ��ͬ���������(����)
A.���ڲ����ͼ�
B.������ȡ����Ӧ�������ӳɷ�Ӧ
C.�����е�����ԭ�Ӷ�����ͬһ��ֱ����
D.��ʹ����KMnO4��Һ��ɫ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����̼�������Ե��ܺġ�����Ⱦ�����ŷ�Ϊ�����ľ���ģʽ����̼���õĸ������й���Ѹ�ٴӸ߶˸����ݱ��ȫ������Ϊ��������Դ��������ҵ���ܵȶ����������Ϊ�������û�ѧ��Ӧԭ�������֪ʶ�о�̼���仯���������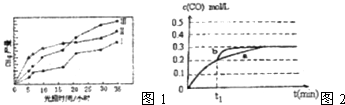
��1��ʵ�����ﳣ��NaOH��Һ����CO2 �� ����100mL 3molL��1��NaOH��Һ����4.48L����״���£�CO2 �� ��ȫ���շ�Ӧ��������Һ������Ũ���ɴ�С��˳��Ϊ
��2����ҵ�Ͽ�����CO��CO2���Ʊ����Һ��ȼ�ϼ״�����֪��800��ʱ����ѧ��Ӧ�١���Ӧ�ڶ�Ӧ��ƽ�ⳣ���ֱ�Ϊ2.5��1.0��Ӧ�٣�2H2��g��+CO��g��CH3OH��g����H=��90.8kJmol��1
��Ӧ�ڣ�H2��g��+CO2��g��H2O��g��+CO��g����H=+41.2kJmol��1
д����CO2��H2��Ӧ�Ʊ��״����Ȼ�ѧ����ʽ �� 800��ʱ�÷�Ӧ�Ļ�ѧƽ�ⳣ��K����ֵΪ
��3�����ù��ܺ�������ɽ�CO2��H2O��g��ת��ΪCH4��O2 �� ����������ʱ���ڲ�ͬ�������������£�CH4���������ʱ��ı仯��ͼ1��ʾ����0��15h�ڣ��Է�Ӧ��Ч����õĴ�����������ţ�
��4��һ���¶��£���3L�ݻ��ɱ���ܱ������з���������Ӧ�ڣ���֪c��CO���淴Ӧʱ��t�ı仯����a��ͼ2��ʾ����t1ʱ�̸ı�һ������������a��Ϊb����ı�������� �� ����t1ʱ�̣����������3L����ѹ����2L����ͼ�ϻ����仯����
��5�������仯�����ڹ�ҵ�����Ź㷺��Ӧ�ã��ڵؿ��г��������ε���ʽ���ڣ�BaSO4���������Σ���ҵ����ȡ��ʱ������Na2CO3��Һ��BaSO4ת�������������Σ�BaCO3������д����BaSO4ת����BaCO3�����ӷ���ʽ�÷�Ӧ��ƽ�ⳣ��Ϊ����������֣�����֪Ksp��BaSO4��=1.1��10��10mol2L��2 �� Ksp��BaCO3��=2.5��10��9mol2L��2
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����и���Һ������÷�Һ©�����ֿܷ�����( )
A������ˮ B�����Ȼ�̼��ˮ C���Ҵ���ˮ D���������ˮ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ֹ��ͪ��F������ֹ�ȡ���̵���ã��������ϳ�·�����£���֪��CH3COOH3COOC3H3+CH3Cl ![]()
![]() +HCl
+HCl 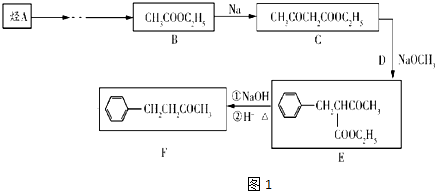
��1��E�к��еĹ���������Ϊ
��2����֪DΪ�Ȼ�����д��C+D��E�Ļ�ѧ����ʽ �� �䷴Ӧ����Ϊ
��3��1molH2�ӳɺ������л���M����������������M��ͬ���칹�����֣��ٱ��Ķ�Ԫȡ����
��1molBr2��Ũ��ˮ��ȫ������Ӧ��д����������������ȡ������֧����һ�ֽṹ ��
��4��������������Ϣ����������Ϊԭ�ϣ��ϳ�Ŀ��߷��ӻ����������ͼ��ͼ2���뽫�հ״����̲���������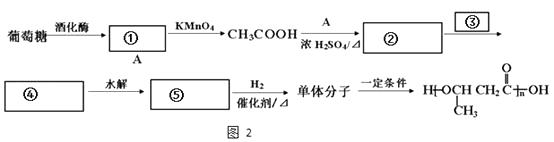
����������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ȼ�ϵ�������л���Ϊȼ�ϣ�ֱ�ӻ�������ø��Ϊ������һ�������ȼ�ϵ�أ�������ת��Ч�ʸߣ���һ�����������ϵ���ɫ��أ��乤��ԭ����ͼ��ʾ�������й�˵����ȷ���ǣ� �� 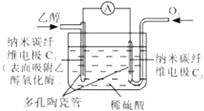
A.O2��C2�缫�ϵõ��ӣ�������
B.������C2�������·����C1��
C.ÿת��6mole��1 �� ����������22.4LCO2
D.C1���ĵ缫��ӦʽΪ��C2H5OH+3H2O��12e��1=2CO2+12H+
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����۷��ɸĽ��л��߷��ӻ���������ʣ��߷��Ӿۺ���P�ĺϳ�·�����£�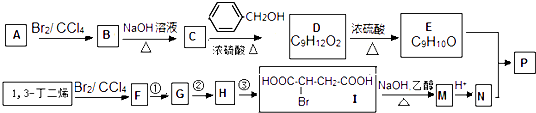
��1��B������Ϊ �� E�����������ŵ�����Ϊ ��
��2��F����ʹ��ˮ��ɫ�����Тڵķ�Ӧ�Լ��� �� �۵ķ�Ӧ������ ��
��3������˵����ȷ����������ĸ��ţ���a��C����ˮ����������
b��A��1��3һ����ϩ��Ϊͬϵ��
c����I����M��1mol�������3mol NaOH
d��N������˳���칹��
��4��д��E��N�������ʵ���֮��Ϊ1��1������������P�Ļ�ѧ��Ӧ����ʽ�� �� �߾���P����ˮ�Ա���E�γɵľۺ������ǿ������������
��5��D��ͬϵ��K��D������һ��̼ԭ�ӣ�K�ж���ͬ���칹�壬��������������K��ͬ���칹�����֣�д�����к˴Ź�������Ϊ1��2��2��2��3��һ��ͬ���칹��Ľṹ��ʽ�� �� a�������������ֵ�Ч��
b����������������Һ��Ӧ
c��һ��������1mol���л��������������Ƴ�ַ�Ӧ������1mol H2 ��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com