
【题目】生物燃料电池是以有机物为燃料,直接或简介利用酶作为催化剂的一类特殊的燃料电池,其能量转化效率高,是一种真正意义上的绿色电池.其工作原理如图所示.下列有关说法正确的是( ) 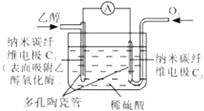
A.O2在C2电极上得电子,被氧化
B.电子由C2极经外电路流向C1极
C.每转移6mole﹣1 , 理论上生成22.4LCO2
D.C1极的电极反应式为:C2H5OH+3H2O﹣12e﹣1=2CO2+12H+
 出彩同步大试卷系列答案
出彩同步大试卷系列答案科目:高中化学 来源: 题型:
【题目】硫酰氯(SO2Cl2)常用做氯化剂或氯磺化剂,如芳香族化合物的氯化、羧酸的氯化及其他各种有机和无机化合物的氯化,也用于制造药品、燃料、表面活性剂等.硫酰氯通常条件下为无色液体,熔点为﹣54.1℃,沸点为69.1℃,在潮湿空气中易“发烟”,100℃以上便开始分解为二氧化硫和氯气,工业上常采用氧化法合成硫酰氯,将干燥的二氧化硫和氯气在一定条件下进行反应,其反应原理和实验装置如下: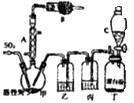
SO2(g)+Cl2(g) ![]() SO2Cl2(l)△H=﹣97.3kJmol﹣1 请回答下列问题:
SO2Cl2(l)△H=﹣97.3kJmol﹣1 请回答下列问题:
(1)仪器A的名称是
(2)干燥管B中盛放的药品是 , 作用是
(3)实验时从仪器C中放出液体的操作方法是
(4)装置乙中盛放的物质为 , 若缺少装置乙,对实验结果有什么影响?
(5)氯磺酸(ClSO3H)是一种无色的发烟液体,有刺激性臭味,沸点178℃,受热分解也能制得硫酰氯,同时还有另外一种物质生成,该反应的化学方程式为 , 分离产物的方法是
A.重结晶 B.过滤 C.蒸馏 D.萃取
(6)为提高本实验中硫酰氯的产率,在实验操作中需要注意的事项有(填序号)
A.控制气流速度,宜慢不宜快
B.水浴加热三劲烧瓶
C.若三劲烧瓶发烫,可适当降温.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25 ℃时,在浓度均为1 mol·L-1的(NH4)2SO4、(NH4)2CO3、(NH4)2Fe(SO4)2的溶液中,测得其中c(NH![]() ) 分别为a,b,c(mol·L-1),则下列判断正确的是( )
) 分别为a,b,c(mol·L-1),则下列判断正确的是( )
A. c>a>b B. a>b>c C. b>a>c D. a>c>b
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】运用盖斯定律可计算一些不易测定的反应的反应热.
(1)已知在298K时下述反应的有关数据:C(s)+ ![]() O2(g)=CO(g)△H1=﹣110.5kJmol﹣1 , C(s)+O2(g)=CO2(g)△H2=﹣393.5kJmol﹣1 . 则C(s)+CO2(g)=2CO(g) 的△H为 .
O2(g)=CO(g)△H1=﹣110.5kJmol﹣1 , C(s)+O2(g)=CO2(g)△H2=﹣393.5kJmol﹣1 . 则C(s)+CO2(g)=2CO(g) 的△H为 .
(2)火箭发射时可用肼(N2H4)为燃料,以二氧化氮作氧化剂,它们相互反应生成氮气和水蒸气.已知:N2(g)+2O2(g)=2NO2(g)△H=+67.7kJmol﹣l;N2H4(g)+O2(g)=N2(g)+2H2O(g)△H=﹣534kJmol﹣l . 则N2H4和NO2反应生成氮气和水蒸气的热化学方程式为
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知某溶液中含有下列8种离子中的5种(忽略水的电离及离子的水解):K+、Cu2+、Al3+、Fe2+、Cl﹣、CO32﹣、NO3﹣、SO42﹣ , 且5种离子的物质的量浓度相等.为了进一步探究该水溶液的组成,某同 学进行了如下实验:
①用铂丝蘸取少量溶液,在火焰上灼烧,透过蓝色钴玻璃观察无紫色火焰.
②另取溶液加入足量盐酸,有无色气体生成,该无色气体遇空气变成红棕色.
③另取溶液加入BaCl2溶液,有白色沉淀生成.
根据上述实验,以下推测正确的是( )
A.无法确定溶液中是否存在Cu2+离子
B.原溶液中不含K+、Al3+、CO![]() 等离子
等离子
C.根据步骤②只能确定溶液中一定存在NO3﹣离子
D.步骤③所得到的白色沉淀共有2种钡盐
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】组成蛋白质的元素主要有C、H、O、N及S、P和少量的Zn、Cu等.
(1)N、P、S的第一电离能由小到大的顺序为 .
(2)组成蛋白质的最简单的氨基酸(HOOCCH2NH2)介子中,π键数目为 .
(3)Zn2+、Cu2+能与NH3、H2O、Cl﹣等形成配位数为4的配合物.①基态Zn2+的价电子(外围电子)排布式为 .
②[Zn(H2O)4]SO4中不存在的化学键类型有 . (填序号).
a.配位键 b.金属键 c.共价键 d.氢键 e.离子键
③[Cu(NH3)4]2+具有对称的空间构型,[Cu(NH3)4]2+中的两个NH3被两个Cl﹣取代,能得到两种不同结构的产物,则[Cu(NH3)4]2+的空间构型为 .
a.平面正方形 b.正四面体 c.三角锥形 d.V形
(4)由上述几种元素组成的6一氨基青霉烷酸的结构如图,其中采用sp3杂化的原子除了S外,还有 .
(5)紫外光的光子所具有的能量约为399kJmol﹣根据下表有关蛋白质分子中主要化学键的键能信息,说明人体长时间照射紫外光后皮肤易受伤害的原因是(填序号).
共价键 | C﹣C | C﹣N | C﹣S |
键能/(kJmol﹣1) | 347 | 305 | 259 |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对可逆反应4NH3(g)+5O2(g) ![]() 4NO(g)+6H2O(g),下列叙述正确的是
4NO(g)+6H2O(g),下列叙述正确的是
A. 达到化学平衡时4v正(O2)=5v逆(NO)
B. 若单位时间内生成x mol NO的同时,消耗x mol NH3,则反应达到平衡状态
C. 达到化学平衡时,若增大容器容积,则正反应速率减小,逆反应速率增大
D. 化学反应速率关系:2v正(NH3)=3v正(H2O)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com