
����Ŀ����֪ij��Һ�к�������8�������е�5�֣�����ˮ�ĵ��뼰���ӵ�ˮ�⣩��K+��Cu2+��Al3+��Fe2+��Cl����CO32����NO3����SO42�� �� ��5�����ӵ����ʵ���Ũ����ȣ�Ϊ�˽�һ��̽����ˮ��Һ����ɣ�ijͬ ѧ����������ʵ�飺
���ò�˿պȡ������Һ���ڻ��������գ�����ɫ�ܲ����۲�����ɫ���森
����ȡ��Һ�����������ᣬ����ɫ�������ɣ�����ɫ������������ɺ���ɫ��
����ȡ��Һ����BaCl2��Һ���а�ɫ�������ɣ�
��������ʵ�飬�����Ʋ���ȷ���ǣ� ��
A.��ȷ����Һ���Ƿ����Cu2+����
B.ԭ��Һ�в���K+��Al3+��CO![]() ������
������
C.���ݲ����ֻ��ȷ����Һ��һ������NO3������
D.��������õ��İ�ɫ��������2�ֱ���
���𰸡�B
���������⣺�ò�˿պȡ������Һ���ڻ��������գ�����ɫ�ܲ����۲�����ɫ���棬��˵��û��K+��
��ȡ��Һ��������ϡ���ᣬ����ɫ�������ɣ�����ɫ������������ɺ���ɫ����˵�����о��������Ե�NO3���ͻ�ԭ�Ե�Fe2+��
������Һ�м���BaCl2��Һ���а�ɫ�������ɣ�˵��ԭ��Һ�к���CO32����SO42�� �� ��Ϊ��Fe2+ �� Fe2+��CO32�����ܹ��棬����û��CO32����
����Һ�е�������Fe2+��NO3����SO42�� ��
��֪�������ӵ����ʵ���Ũ����ȣ������ӵ�ɱ������ӵ�ɶ࣬���Ի��������������Cu2+��Al3+ �� ����Cu2+ �� �����ӵĵ�ɶ����Cl�� �� ����Al3+ �� �����Ӽ���Cl�� �� ����Բ��غ㣻
���Ը��ݵ���غ��֪����Cu2+��Cl�� ��
����ԭ��Һ������������Ϊ��Cu2+��Fe2+��Cl����NO3����SO42�� �� һ��������K+��Al3+��CO32�����ӣ�
A��Cu2+һ�����ڣ���A����
B���������Ϸ�����ԭ��Һ�в���������Ϊ��K+��Al3+��CO32�� �� ��B��ȷ��
C�����������ȡ��Һ��������ϡ���ᣬ����ɫ�������ɣ�����ɫ������������ɺ���ɫ����˵�����о��������Ե�NO3���ͻ�ԭ�Ե�Fe2+ �� ��CO32�� �� ��C����
D����ȡ��Һ����BaCl2��Һ��ֻ�������ᱵ��������D����
��ѡB��
�ò�˿պȡ������Һ���ڻ��������գ�����ɫ�ܲ����۲�����ɫ���棬��˵��û��K+��
��ȡ��Һ��������ϡ���ᣬ����ɫ�������ɣ�����ɫ������������ɺ���ɫ����˵�����о��������Ե�NO3���ͻ�ԭ�Ե�Fe2+��
������Һ�м���BaCl2��Һ���а�ɫ�������ɣ�˵��ԭ��Һ�к���CO32����SO42�� �� ��Ϊ��Fe2+ �� Fe2+��CO32�����ܹ��棬����û��CO32����
����Һ�е�������Fe2+��NO3����SO42�� ��
��֪�������ӵ����ʵ���Ũ����ȣ������ӵ�ɱ������ӵ�ɶ࣬���Ի��������������Cu2+��Al3+ �� ����Cu2+ �� �����ӵĵ�ɶ����Cl�� �� ����Al3+ �� �����Ӽ���Cl�� �� ����Բ��غ㣻
���Ը��ݵ���غ��֪����Cu2+��Cl�� ��
����ԭ��Һ������������Ϊ��Cu2+��Fe2+��Cl����NO3����SO42�� �� һ��������K+��Al3+��CO32�����ӣ��ݴ˷���ѡ�



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��úȼ���ŷŵ���������SO2��NOx���γ����ꡢ��Ⱦ����������NaClO2��Һ��Ϊ���ռ���ͬʱ���������������������ش��������⣺
��1���ڹ��ݷ�Ӧ����ͨ�뺬��SO2��NO����������Ӧ�¶�Ϊ323 K��NaClO2��ҺŨ��Ϊ 5��103mol��L1����Ӧһ��ʱ�����Һ������Ũ�ȵķ���������±���
���� | SO42�� | SO32�� | NO3�� | NO2�� | Cl�� |
c/��mol��L1�� | 8.35��104 | 6.87��106 | 1.5��104 | 1.2��105 | 3.4��103 |
��д��NaClO2��Һ������������Ҫ��Ӧ�����ӷ���ʽ___________________________________������ѹǿ��NO��ת����______________�����������������������������������
���������շ�Ӧ�Ľ��У����ռ���Һ��pH��______________ ��������������������������С������
����ʵ������֪������Ӧ����______������Ӧ���ʣ���������������С��������ԭ���dz���SO2��NO�������еij�ʼŨ�Ȳ�ͬ����������________________��
��2���ڲ�ͬ�¶��£�NaClO2��Һ���������ķ�Ӧ�У�SO2��NO��ƽ���ѹpc��ͼ��ʾ����ͼ������֪����Ӧ�¶����ߣ�����������Ӧ��ƽ�ⳣ����_________����������������������������С������

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����и���Һ������÷�Һ©�����ֿܷ�����( )
A������ˮ B�����Ȼ�̼��ˮ C���Ҵ���ˮ D���������ˮ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ��������ʢ�к�ˮ���������б���ʴʱ���ɿ쵽����˳���ǣ� �� 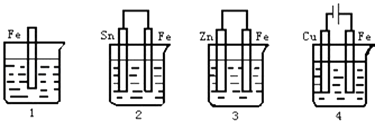
A.4��2��1��3
B.2��1��3��4
C.4��2��3��1
D.3��2��4��1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ȼ�ϵ�������л���Ϊȼ�ϣ�ֱ�ӻ�������ø��Ϊ������һ�������ȼ�ϵ�أ�������ת��Ч�ʸߣ���һ�����������ϵ���ɫ��أ��乤��ԭ����ͼ��ʾ�������й�˵����ȷ���ǣ� �� 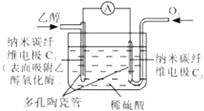
A.O2��C2�缫�ϵõ��ӣ�������
B.������C2�������·����C1��
C.ÿת��6mole��1 �� ����������22.4LCO2
D.C1���ĵ缫��ӦʽΪ��C2H5OH+3H2O��12e��1=2CO2+12H+
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������ѧ��ȤС�����������̽�������һ�飺Ϊ�о����ʲ�������Ũ����ķ�Ӧ��
��1����ȡ������̼�ظ֣�12.0g����30.0mLŨ�����У����ȣ���ַ�Ӧ��õ���ҺX���ռ�������Y���ټ�ͬѧ��ΪX�г�Fe3+����ܺ���Fe2+ �� ��Ҫȷ�������Ƿ���Fe2+ �� Ӧѡ�������Լ�Ϊ��ѡ����ţ���
a��KSCN��Һ����ˮ b�����ۺ�KSCN��Һ c��Ũ��ˮ d������KMnO4��Һ
����ͬѧȡ672mL����״��������Yͨ��������ˮ�У�������Ӧ��SO2+Br2+2H2O=2HBr+H2SO4Ȼ���������BaCl2��Һ�����ʵ�������õ��������4.66g���ݴ���֪����Y��SO2���������Ϊ������С�����һλ����������ʵ����SO2��������Ľ������ͬѧ��Ϊ����Y�л����ܺ�����H2��CO2���壮Ϊ�����������̽��ʵ��װ�ã�ͼ�мг�����ʡ�ԣ���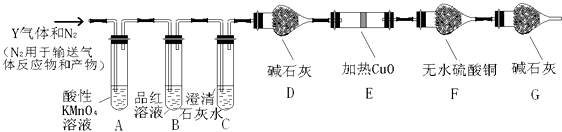
��д������CO2�Ļ�ѧ����ʽ ��
��װ��A���Լ��������� �� װ��G���Լ��������� ��
�ݼ���ȷ������Y�к���CO2��ʵ������ ��
���������Y�к���H2 �� Ԥ��ʵ������Ӧ�� ��
��2���ڶ��飺��������װ�ö�������������SO2�ĺ�����  ��KMnO4��Һ�е���ĩ��������״��ṹ��������
��KMnO4��Һ�е���ĩ��������״��ṹ��������
�ڸ�ʵ�����Ѿ�֪������������������aL/min������KMnO4��Һ�����bL����Ũ��Ϊcmol/L����������ͨ�뵽��ɫǡ����ȥ����ʱ5���ӣ���˴�ȡ�����Ŀ����ж���������Ϊg/L������֪KMnO4����ԭ�IJ���ͨ��ΪMn2+��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����һ��ɫδ֪��Һ�м������Ba2+��Ag+ �� ͬʱ�ֲ�������Ժ�ǿ��ijѧ����Ҫ��������Һ���Ƿ�������ڢ�Cu2+ ��Al3+ ��Cl�� ��NO ![]() ��NH4+ ��CO
��NH4+ ��CO ![]() ��S2�� ��Mg2+����Fe3+ �� ����ʵ���в������Ӳ��ü������ܼ��Է�����Ϊ���ؼ������ǣ� ��
��S2�� ��Mg2+����Fe3+ �� ����ʵ���в������Ӳ��ü������ܼ��Է�����Ϊ���ؼ������ǣ� ��
A.�ۢݢޢߢ�
B.�٢ۢޢߢ�
C.�ۢܢߢ��
D.�٢ڢۢݢ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ԭ���������ε����ļס��ҡ����������������ڱ���ǰ30��Ԫ�أ����мס��ҡ�����Ԫ�صĻ�̬ԭ��2p�ܼ����е����ӣ������Ӹ����ֱ���2��3��2��������ԭ���������18����Ԫ�������ڱ���ds���ĵ�һ��Ԫ�ء��ش��������⣺
��1�������γɶ��ֳ������ʣ����۵�ܸߵ����ֳ��������У�ԭ�ӵ��ӻ���ʽ�ֱ�Ϊ______��__________��
��2��+1����̬��̬��������ʧȥһ�������γ�+2����̬��̬����������Ҫ��������Ϊ�ڶ�������I2�����λ���I3��I4��I5�����ƲⶡԪ�صĵ�����ͻ��Ӧ�����ڵ�________�����ܡ�
��3����Ļ�̬ԭ����________����״��ͬ��ԭ�ӹ����
��4���ס��ҷֱ�������γ�ԭ�Ӹ�����Ϊ 1:3����������������Ŀռ乹�ͷֱ�Ϊ��_________________ ��__________________��
��5�����Ͷ��γɵ�һ�����ӻ�����ľ����ṹ����ͼ���þ����������ӵ���λ��Ϊ_________ ����һ����������Χ���������������Ϊ���㹹�ɵļ�����Ϊ_______________����֪�þ������ܶ�Ϊ�� g/cm3�������ӵ�����ΪNA���û��������Է�������Ϊ M����þ����к���İ뾶r =_____cm�����ú�����NA�ļ���ʽ��ʾ��

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ϳɰ������Ĵ����������˹��̵�����Ҫ;�������о�����ȷ������ָ�����ϳɰ���ӦN2+3H2![]() 2NH3��ƽ�ⳣ��Kֵ���¶ȵĹ�ϵ���£�
2NH3��ƽ�ⳣ��Kֵ���¶ȵĹ�ϵ���£�
�¶�/�� | 360 | 440 | 520 |
Kֵ | 0.036 | 0.010 | 0.0038 |
��1�����ɱ������ݿ�֪�÷�ӦΪ______��Ӧ������������������������
�������ϣ�Ϊ������ƽ��ʱH2��ת���ʣ��ɲ�ȡ�Ĵ�ʩ��______________������ĸ�������
a������ѹǿ b��ʹ�ú��ʵĴ���
c�������¶� d����ʱ����������е�NH3
��2��ԭ����H2��ͨ����ӦCH4��g��+H2O��g�� ![]() CO��g��+3H2��g����ȡ����֪�÷�Ӧ�У�����ʼ������е�
CO��g��+3H2��g����ȡ����֪�÷�Ӧ�У�����ʼ������е�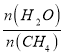 �㶨ʱ���¶ȡ�ѹǿ��ƽ��������CH4������Ӱ����ͼ��ʾ��
�㶨ʱ���¶ȡ�ѹǿ��ƽ��������CH4������Ӱ����ͼ��ʾ��

��ͼ�У��������߱�ʾѹǿ�Ĺ�ϵ��p1________p2������>��������������<������
�ڸ÷�ӦΪ________��Ӧ��������������������������
��3��ԭ����H2����ͨ����ӦCO��g��+H2O��g�� ![]() CO2��g��+H2��g����ȡ��T ��ʱ�����ݻ��̶�Ϊ2 L�������г���1 molˮ������1 mol CO����Ӧ��ƽ����CO2��Ũ��Ϊ0.3 mol��L��1����ƽ��ʱCO��ת����Ϊ________
CO2��g��+H2��g����ȡ��T ��ʱ�����ݻ��̶�Ϊ2 L�������г���1 molˮ������1 mol CO����Ӧ��ƽ����CO2��Ũ��Ϊ0.3 mol��L��1����ƽ��ʱCO��ת����Ϊ________
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com