
【题目】香料M的一种合成流程如下:
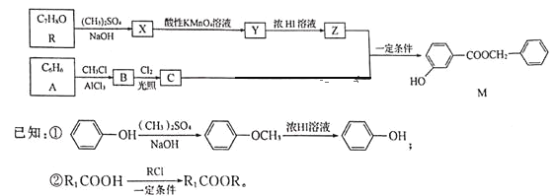
请回答下列问题:
(1)M中含碳的官能团名称是__;设计R→X和Y→Z步骤的目的是__。
(2)A→B的反应类型是___,B的名称是___。
(3)R分子中最多有__个原子共平面。
(4)R和M在下列仪器中信号完全相同的是___(填字母)。
a.质谱仪 b.元素分析仪 c.红外光谱仪 d.核磁共振氢谱仪
(5)写出C和Z反应生成M的化学方程式:___。
(6)在Y的同分异构体中,同时满足下列条件的结构有___种(不考虑立体异构)。
①能发生银镜反应
②遇氯化铁溶液发生显色反应
③1mol有机物最多能消耗3molNaOH
(7)已知苯环上有烃基时,新引入取代基主要取代邻位、对位氢原子。参照上述合成流程,设计以苯和异丙醇为原料制备Br![]() 的合成路线:___(无机试剂任选)
的合成路线:___(无机试剂任选)
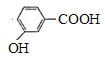
【答案】酯基 保护酚羟基 取代反应 甲苯 14 b ![]() +
+
![]()
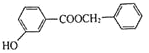 +HCl 10 :CH3CH(OH)CH3
+HCl 10 :CH3CH(OH)CH3![]() CH3CHBrCH3
CH3CHBrCH3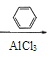
![]()
![]() Br
Br![]()
【解析】
由A的分子式,结合M的结构简式,则A为![]() ,
,![]() 与CH3Cl在无水AlCl3作用下,发生取代反应生成B,则B的结构简式为
与CH3Cl在无水AlCl3作用下,发生取代反应生成B,则B的结构简式为![]() ,B在Cl2在光照条件下反应生成C,C的结构简式为
,B在Cl2在光照条件下反应生成C,C的结构简式为![]() ,Z为
,Z为 ,由R的分子式,结合已知信息①,可知R的结构简式为
,由R的分子式,结合已知信息①,可知R的结构简式为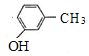 ,X为
,X为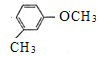 ,X在酸性高锰酸钾溶液作用下被氧化生成Y,Y的结构简式为
,X在酸性高锰酸钾溶液作用下被氧化生成Y,Y的结构简式为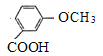 。
。
由分析可知:A为![]() ,B的结构简式为
,B的结构简式为![]() ,,C的结构简式为
,,C的结构简式为![]() ,R的结构简式为
,R的结构简式为 ,X为
,X为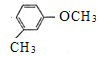 ,Y的结构简式为
,Y的结构简式为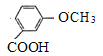 ,Z为
,Z为 。
。
(1)M中含碳的官能团名称是:酯基;设计R→X和Y→Z步骤的目的是保护酚羟基,防止酚羟基被氧化;
(2)A→B是苯环上的H原子被-CH3代替,发生的反应类型是取代反应,B的名称是甲苯;
(3)R的结构简式为 ,旋转单键可以使-CH3中1个H原子、可以使-OH中1个H原子处于苯环的平面上,故最多有14个原子共面;
,旋转单键可以使-CH3中1个H原子、可以使-OH中1个H原子处于苯环的平面上,故最多有14个原子共面;
(4)a.质谱仪是用来测定相对分子质量,R和M的相对分子质量不同,a错误;
b.元素分析仪是用来检测物质中所含的元素,R和M都只含有H、C、O三种元素,所含元素相同,b正确;
c.利用红外光谱可以获得有机物分子中含有何种化学键或官能团信息,R和M含有的官能团与基团不完全相同,c错误;
d.检测有机物分子中不同化学环境中的氢原子,R和M中氢的化学环境不同,d错误;
答案选b;
(5)C和Z反应生成M的化学方程式:![]() +
+
![]()
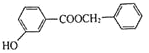 +HCl;
+HCl;
(6)Y(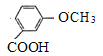 )的同分异构体同时满足下列条件:①能发生银镜反应,说明分子中含有醛基;②遇氯化铁溶液发生显色反应,说明分子中含有酚羟基;③1mol有机物最多能消耗3molNaOH,说明分子中含有酚羟基,-OOCH,还含有-CH3,羟基与甲基在苯环上有邻、间、对3种位置结构,对应的-OOCH,分别有4种、4种、2种结构,故符合条件Y的同分异构体共10种结构;
)的同分异构体同时满足下列条件:①能发生银镜反应,说明分子中含有醛基;②遇氯化铁溶液发生显色反应,说明分子中含有酚羟基;③1mol有机物最多能消耗3molNaOH,说明分子中含有酚羟基,-OOCH,还含有-CH3,羟基与甲基在苯环上有邻、间、对3种位置结构,对应的-OOCH,分别有4种、4种、2种结构,故符合条件Y的同分异构体共10种结构;
(6)由题中信息中定位规律可知:![]() 与溴在催化剂条件下得到目标物。由A→B转化,可知苯与2-溴丙烷得到
与溴在催化剂条件下得到目标物。由A→B转化,可知苯与2-溴丙烷得到![]() 。异丙醇与HBr发生取代反应得到2-溴丙烷。合成路线为:CH3CH(OH)CH3
。异丙醇与HBr发生取代反应得到2-溴丙烷。合成路线为:CH3CH(OH)CH3![]() CH3CHBrCH3
CH3CHBrCH3
![]()
![]() Br
Br![]()


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】某固体混合物可能由Al、( NH4)2SO4、MgCl2、FeCl2、AlCl3中的两种或多种组成,现对该混合物做如下实验,现象和有关数据如图所示(气体体积数据换算成标准状况)。关于该固体混合物,下列说法正确的是( )
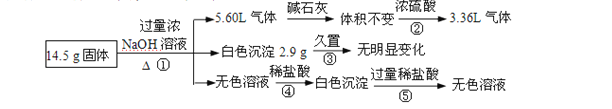
A.含有4.5gAl
B.不含FeCl2、AlCl3
C.含有物质的量相等的( NH4)2SO4和MgCl2
D.含有MgCl2、FeCl2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组离子在指定溶液中一定不能大量共存的是
A.使淀粉碘化钾试纸变蓝的溶液中:K+、SO42-、Na+、ClO-
B.使石蕊试液变红的溶液中:Al3+、Cl-、NH4+、NO3-
C.c(Al3+) = 0.1 mol/L的溶液中:AlO2-、Na+、Cl-、K+
D.![]() = 1×10-13 的溶液中:CH3COO-、CO32-、K+、SO32-
= 1×10-13 的溶液中:CH3COO-、CO32-、K+、SO32-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、W四种物质的转化关系。下列组合中不符合该关系的是( )
X | Y | Z | W |
| |
A | Na2CO3 | CO2 | CaCO3 | Ca(HCO3)2 | |
B | SO2 | Na2SO3 | H2SO4 | NaHSO3 | |
C | HCl | FeCl2 | Cl2 | FeCl3 | |
D | Na2O2 | NaOH | Na2CO3 | NaHCO3 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上制备纯硅反应的热化学方程式如下:SiCl4(g)+2H2(g)![]() Si(s)+4HCl(g) △H=+QkJ·mol-1(Q>0),某温度、压强下,将一定量的反应物通入密闭容器中进行以上的反应(此条件下为可逆反应),下列叙述正确的是
Si(s)+4HCl(g) △H=+QkJ·mol-1(Q>0),某温度、压强下,将一定量的反应物通入密闭容器中进行以上的反应(此条件下为可逆反应),下列叙述正确的是
A.反应过程中,若增大压强能提高SiCl4的转化率
B.当反应吸热为0.025QkJ时,生成的HCl与100mL1mol·L-1的NaOH溶液恰好反应
C.反应至4min时,若HCl的浓度为0.12mol·L-1,则H2的反应速率为0.03mol/(L·min)
D.若反应开始时SiCl4为1mol,则达到平衡时,吸收热量为QkJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮氧化物是环境污染物,研究氮氧化物转化有重要的意义。回答下列问题:
(1)催化转化器可使汽车尾气反应而转化:2NO(g)+2CO(g)![]() N2(g)+2CO2(g) ΔH
N2(g)+2CO2(g) ΔH
已知:2C(s)+O2(g)=2CO(g) ΔH1=akJ·mol-1;
C(s)+O2(g)=CO2(g) ΔH2=bkJ·mol-1;
N2(g)+O2(g)=2NO(g) ΔH3=ckJ·mol-1
ΔH=__kJ·mol-1(用含a、b、c的代数式表示);
(2)T℃时,将等物质的量的NO和CO充入容积为1L的密闭容器中发生尾气转化反应,容器中NO物质的量随时间变化如图所示。
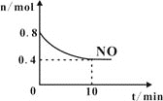
①T℃时,该化学反应的平衡常数K=___。
②下列事实能判断汽车尾气转化反应达到到化学平衡状态的是___;
A.体系中NO的转化率和CO的转化率相等 B.气体的密度不再变化
C.NO消耗速率等于N2消耗速率的2倍 D.混合气体平均相对分子质量不再变化
③已知汽车尾气转化反应的ΔH<0。10min后,改变下列示意图横坐标对应的反应条件,纵坐标对应的量变化关系不正确的是___。(填序号)
a.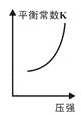 b.
b.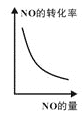 c.
c.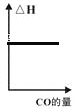 d.
d.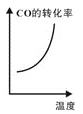
(3)碘蒸气存在能大幅度提高N2O的分解速率,反应历程为:
第一步I2(g)![]() 2I(g)(快反应)
2I(g)(快反应)
第二步I(g)+N2O(g)→N2(g)+IO(g)(慢反应)
第三步IO(g)+N2O(g)→N2(g)+O2(g)+I(g)(快反应)
实验表明,含碘时N2O分解速率方程v=k·c(N2O)·[c(I2)]0.5(k为速率常数)。
下列表述不正确的是___(填标号)。
A.IO为反应的中间产物
B.第二步活化能比第三步小
C.第二步对总反应速率起决定作用
D.N2O分解反应中,k值与是否含碘蒸气无关
(4)碱吸收、碳还原是目前工业生产中处理氮氧化物的常用方法。
①碱吸收的常见产物为NaNO2。常温下,pH=8的NaNO2溶液中c(Na+)-c(NO2-)=___mol·L-1(用精确值表示);
②碳还原法是在高温条件下将NO与NO2混合气体与焦炭反应,生成CO2和N2,且物质的量之比为4:3,写出该方法的化学方程式___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】肉桂酸(![]() )常用于制取香精香料。
)常用于制取香精香料。
(1)肉桂酸的分子式是____,肉桂酸____(填“属于”或“不属于”)烃类。
(2)肉桂酸能使溴的四氯化碳溶液褪色,因为结构中含____(填官能团名称)。
(3)向肉桂酸溶液中滴加NaHCO3溶液,实验现象为____。
(4)写出肉桂酸与乙醇发生酯化反应的化学方程式:____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】新型材料B4C可用于制作切削工具和高温热交换器。关于B4C的推断正确的是
A. B4C是一种分子晶体B. B4C是该物质的分子式
C. B4C是一种原子晶体D. B4C的电子式为![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某兴趣小组为研究上述反应中钾元素的熔出率(液体中钾元素的质量占样品质量的百分率)与温度的关系,进行实验(保持其它条件不变),获得数据曲线如图。
主要反应是:NaCl(l)+KAlSi3O8(s)KCl(l)+NaAlSi3O8(s)+Q;
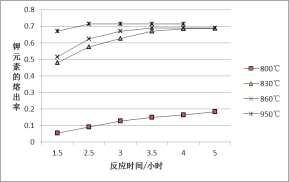
(1)分析数据可知,Q_______0(选填“>”或“<”)。
(2)950℃时,欲提高钾的熔出速率可以采取的措施是_______(填序号)。
a.延长反应时间 b.充分搅拌
c.增大反应体系的压强 d.将钾长石粉粹成更小的颗粒
(3)要使钾元素的熔出率和熔出速率都达到最大,反应温度应为_____________。
(4)工业上常用KCl冶炼金属钾。反应方程式为:Na(l)+KCl(l)![]() NaCl(l)+K(g)用平衡移动原理解释该方法可行的原因:_________________。
NaCl(l)+K(g)用平衡移动原理解释该方法可行的原因:_________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com