
【题目】新型材料B4C可用于制作切削工具和高温热交换器。关于B4C的推断正确的是
A. B4C是一种分子晶体B. B4C是该物质的分子式
C. B4C是一种原子晶体D. B4C的电子式为![]()
科目:高中化学 来源: 题型:
【题目】实验室制取少量溴乙烷的装置如图所示,将生成物导入盛有冰水混合物的试管a中,实验结束发现试管a中的物质分为三层.对该实验的分析错误的是( )

A. 烧瓶中除发生取代反应可能发生消去反应、氧化还原反应等
B. 产物在a中第一层
C. a中有产物和水还含HBr、CH3CH2OH等
D. b中盛放的酸性KMnO4溶液会褪色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】香料M的一种合成流程如下:
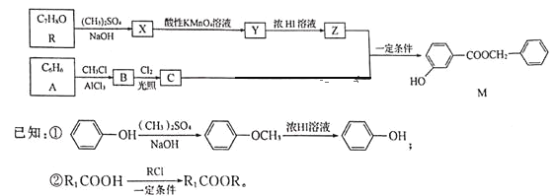
请回答下列问题:
(1)M中含碳的官能团名称是__;设计R→X和Y→Z步骤的目的是__。
(2)A→B的反应类型是___,B的名称是___。
(3)R分子中最多有__个原子共平面。
(4)R和M在下列仪器中信号完全相同的是___(填字母)。
a.质谱仪 b.元素分析仪 c.红外光谱仪 d.核磁共振氢谱仪
(5)写出C和Z反应生成M的化学方程式:___。
(6)在Y的同分异构体中,同时满足下列条件的结构有___种(不考虑立体异构)。
①能发生银镜反应
②遇氯化铁溶液发生显色反应
③1mol有机物最多能消耗3molNaOH
(7)已知苯环上有烃基时,新引入取代基主要取代邻位、对位氢原子。参照上述合成流程,设计以苯和异丙醇为原料制备Br![]() 的合成路线:___(无机试剂任选)
的合成路线:___(无机试剂任选)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知反应:2NO(g)+Br2(g)![]() 2NOBr(g) △H=-a kJ·mol-1 (a>0),其反应机理如下
2NOBr(g) △H=-a kJ·mol-1 (a>0),其反应机理如下
①NO(g)+Br2(g)![]() NOBr2(g) 快 ②NO(g)+NOBr2(g)
NOBr2(g) 快 ②NO(g)+NOBr2(g)![]() 2NOBr(g) 慢
2NOBr(g) 慢
下列有关该反应的说法正确的是( )
A. 该反应的速率主要取决于①的快慢
B. NOBr2是该反应的催化剂
C. 正反应的活化能比逆反应的活化能小a kJ·mol-1
D. 增大Br2(g)浓度能增大活化分子百分数, 加快反应速率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国的四大发明之一黑火药,爆炸时发生反应的化学方程式为:S + 2KNO3 + 3C → K2S + 3CO2↑+ N2↑。请根据其中所含的元素回答下列问题:
(1)如图所示为元素周期表中钾元素框图,数据“39.10”表示的是________;钾元素在周期表中的位置为___________________。
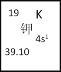
(2)上述元素中,简单离子电子层结构与氩原子相同,且离子半径最大的元素,其原子核外有_____种不同能级的电子;已知其氧化物中一种对应水化物能与氯单质反应,该反应的化学方程式是__________________________________。
(3)上述反应生成物中,属于非电解质的是_________________(写结构式);其中熔点最高的物质的电子式是______________。
(4)上述化学方程式的元素中,属于同周期元素的非金属性由强到弱的顺序为_______________,能证明其递变规律的事实是_______________(填字母)。
A、最高价氧化物对应水化物的酸性 B、气态氢化物的沸点
C、单质与氢气反应的难易程度 D、其两两组合形成的化合物中元素的化合价
(5)上述反应中,如1.5mol还原剂________(填“得到”或“失去”)________ mol电子,则生成_________ g还原产物。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,向10 mL 0.1 mol/LCuCl2溶液中滴加0.1 mol/L的Na2S溶液,滴加过程中溶液中lgc(Cu2+)与Na2S溶液体积(V)的关系如图所示,下列有关说法正确的是

已知:lg2=0.3,Ksp(ZnS)=3×10-25 mol2/L2。
A. a、b、c三点中,水的电离程度最大的为b点
B. Na2S溶液中:c(H+)+c(HS-)+c(H2S)= c(OH-)
C. 该温度下Ksp(CuS)=4×10-36 mol2/L2
D. 向100 mL Zn2+、Cu2+浓度均为10-5 molL-1的混合溶液中逐滴加入10-4 molL-1的Na2S溶液,Zn2+先沉淀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙二酸俗称草酸(结构简式为HOOC﹣COOH,可简写为H2C2O4),它是一种重要的化工原料.(常温下0.01mol/L的H2C2O4、KHC2O4、K2C2O4溶液的pH如表所示.)
H2C2O4 | KHC2O4 | K2C2O4 | |
pH | 2.1 | 3.1 | 8.1 |
填空:
(1)写出H2C2O4的电离方程式_______.
(2)KHC2O4溶液显酸性的原因是_____;向0.1mol/L的草酸氢钾溶液里滴加NaOH溶液至中性,此时溶液里各粒子浓度关系正确的是______.
a.c(K+)=c(HC2O4﹣)+c(H2C2O4)+c(C2O42﹣)
b.c(Na+)=c(H2C2O4)+c(C2O42﹣)
c.c(K+)+c(Na+)=c(HC2O4﹣)+c(C2O42﹣)
d.c(K+)>c(Na+)
(3)H2C2O4与酸性高锰酸钾溶液反应,现象是有气泡(CO2)产生,紫色消失.写出反应的离子方程式______;又知该反应开始时速率较慢,随后大大加快,可能的原因是_______.
(4)某同学设计实验如图所示:两个烧杯中的试管都分别盛有2mL 0.1 mol/L H2C2O4溶液和4mL 0.1mol/L 酸性KMnO4溶液,分别混合并振荡,记录溶液褪色所需时间.该实验目的是研究________,但该实验始终没有看到溶液褪色,推测原因_______.
(5)已知草酸(H2C2O4)受热分解的化学方程式为:H2C2O4→H2O+CO↑+CO2↑,写出FeC2O4在密闭容器中高温分解的化学方程式________.

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图两个装置中,液体体积均为200ml,开始时电解质溶液的浓度均为 0.1mol/L,工作一段时间后,测得导线上都通过了0.02mol电子,若不考虑溶液体积的变化,下列叙述正确的是( )

A. 产生气体体积①=②
B. 电极上析出固体质量①<②
C. 溶液的pH变化:①减小②增大
D. 电极反应式:①中阳极Cu2++2e-=Cu,②中负极Zn-2e-=Zn2+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下面是合成某药物的中间体分子(由9个碳原子和若干氢、氧原子构成)的结构示意图:
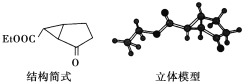
试回答下列问题:
(1)通过对比上面的结构简式与立体模型,请指出结构简式中的“Et”表示的基团是(写结构简式)_____;该药物中间体的分子式为________。
(2)该分子中含有_________个不饱和碳原子。
(3)该药物中间体中含氧官能团的名称为___________。
(4)该药物中间体分子中与碳原子结合的氢原子被溴原子取代,所得的一溴代物有______种。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com