
【题目】乙二酸俗称草酸(结构简式为HOOC﹣COOH,可简写为H2C2O4),它是一种重要的化工原料.(常温下0.01mol/L的H2C2O4、KHC2O4、K2C2O4溶液的pH如表所示.)
H2C2O4 | KHC2O4 | K2C2O4 | |
pH | 2.1 | 3.1 | 8.1 |
填空:
(1)写出H2C2O4的电离方程式_______.
(2)KHC2O4溶液显酸性的原因是_____;向0.1mol/L的草酸氢钾溶液里滴加NaOH溶液至中性,此时溶液里各粒子浓度关系正确的是______.
a.c(K+)=c(HC2O4﹣)+c(H2C2O4)+c(C2O42﹣)
b.c(Na+)=c(H2C2O4)+c(C2O42﹣)
c.c(K+)+c(Na+)=c(HC2O4﹣)+c(C2O42﹣)
d.c(K+)>c(Na+)
(3)H2C2O4与酸性高锰酸钾溶液反应,现象是有气泡(CO2)产生,紫色消失.写出反应的离子方程式______;又知该反应开始时速率较慢,随后大大加快,可能的原因是_______.
(4)某同学设计实验如图所示:两个烧杯中的试管都分别盛有2mL 0.1 mol/L H2C2O4溶液和4mL 0.1mol/L 酸性KMnO4溶液,分别混合并振荡,记录溶液褪色所需时间.该实验目的是研究________,但该实验始终没有看到溶液褪色,推测原因_______.
(5)已知草酸(H2C2O4)受热分解的化学方程式为:H2C2O4→H2O+CO↑+CO2↑,写出FeC2O4在密闭容器中高温分解的化学方程式________.

【答案】H2C2O4H++HC2O4﹣;HC2O4﹣H++C2O42﹣ HC2O4﹣的电离程度大于水解程度 ad 2MnO4﹣+5H2C2O4+6H+→2Mn2++10CO2↑+8H2O 反应生成的Mn2+对该反应具有催化作用 温度对反应速率的影响 KMnO4溶液过量 FeC2O4![]() Fe+2CO2↑
Fe+2CO2↑
【解析】
(1)常温下0.01mol/L的H2C2O4pH为2.1,KHC2O4,的pH为3.1,说明草酸是二元弱酸;
(2)HC2O4-既能够电离也能够水解,结合KHC2O4溶液显酸性分析解答;向0.1mol/L的草酸氢钾溶液里滴加NaOH溶液至中性,根据物料守恒和电荷守恒分析判断;
(3)草酸和高锰酸钾溶液在酸性溶液中发生氧化还原反应,草酸被氧化为二氧化碳,高锰酸钾被还原为锰离子,据此书写反应的方程式并配平;反应开始时速率较慢,随后大大加快,结合影响化学反应速率的因素分析解答;
(4)两烧杯中水的温度不同,其余条件相同,结合草酸与高锰酸钾反应的方程式分析解答;
(5)草酸分解能够生成CO,CO具有还原性,据此分析解答。
(1)二元弱酸分步电离,草酸的电离方程式为:H2C2O4H++HC2O4-,HC2O4-H++C2O42-,故答案为:H2C2O4H++HC2O4-;HC2O4-H++C2O42-;
(2)HC2O4-既能够电离也能够水解,KHC2O4溶液显酸性,说明HC2O4-的电离程度大于水解程度;向0.1mol/L的草酸氢钾溶液里滴加NaOH溶液至中性:a.碳元素在溶液中存在形式有:HC2O4-、H2C2O4、C2O42-,根据物料守恒有c(K+)=c(HC2O4-)+c(H2C2O4)+c(C2O42-),故a正确;b.由c(K+)=c(HC2O4-)+c(H2C2O4)+c(C2O42-)、c(K+)+c(Na+)=c(HC2O4-)+2c(C2O42-)可知,c(Na+)=c(C2O42-)-c(H2C2O4),故b错误;c.根据电荷守恒有:c(K+)+c(Na+)+c(H+)=c(HC2O4-)+2c(C2O42-)+c(OH-),溶液呈中性,则c(H+)=c(OH-),故c(K+)+c(Na+)=c(HC2O4-)+2c(C2O42-),故c错误;d.若恰好反应,c(K+)=c(Na+),此时溶液呈碱性,故加入的氢氧化钠的物质的量略少些,即c(K+)>c(Na+),故d正确;故答案为:HC2O4-的电离程度大于水解程度;ad;
(3)草酸和高锰酸钾溶液在酸性溶液中发生氧化还原反应,草酸被氧化为二氧化碳,高锰酸钾被还原为锰离子,反应的离子方程式为:5H2C2O4+2MnO4-+6H+=2Mn2++10CO2↑+8H2O,反应开始时速率较慢,随后大大加快,说明生成的Mn2+对该反应具有催化作用,故答案为:2MnO4-+5H2C2O4+6H+→2Mn2++10CO2↑+8H2O;反应生成的Mn2+对该反应具有催化作用;
(4)两烧杯中水的温度不同,其余条件完全相同,因此该实验是研究温度对反应速率的影响;草酸与高锰酸钾恰好反应时的物质的量之比为5∶2,试管中草酸与高锰酸钾物质的量之比为1∶2,高锰酸钾过量,不能完全反应,所以溶液不褪色,故答案为:温度对反应速率的影响;KMnO4溶液过量;
(5)已知草酸(H2C2O4)受热分解的化学方程式为:H2C2O4→H2O+CO↑+CO2↑,则草酸亚铁受热分解的化学方程式为FeC2O4 ![]() FeO+CO↑+CO2↑,CO能够还原FeO,FeO+CO
FeO+CO↑+CO2↑,CO能够还原FeO,FeO+CO![]() Fe+CO2↑,所以总反应方程式为:FeC2O4
Fe+CO2↑,所以总反应方程式为:FeC2O4![]() Fe+2CO2↑,故答案为:FeC2O4
Fe+2CO2↑,故答案为:FeC2O4![]() Fe+2CO2↑.
Fe+2CO2↑.


 新编小学单元自测题系列答案
新编小学单元自测题系列答案 字词句段篇系列答案
字词句段篇系列答案科目:高中化学 来源: 题型:
【题目】下列各组离子在指定溶液中一定不能大量共存的是
A.使淀粉碘化钾试纸变蓝的溶液中:K+、SO42-、Na+、ClO-
B.使石蕊试液变红的溶液中:Al3+、Cl-、NH4+、NO3-
C.c(Al3+) = 0.1 mol/L的溶液中:AlO2-、Na+、Cl-、K+
D.![]() = 1×10-13 的溶液中:CH3COO-、CO32-、K+、SO32-
= 1×10-13 的溶液中:CH3COO-、CO32-、K+、SO32-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】肉桂酸(![]() )常用于制取香精香料。
)常用于制取香精香料。
(1)肉桂酸的分子式是____,肉桂酸____(填“属于”或“不属于”)烃类。
(2)肉桂酸能使溴的四氯化碳溶液褪色,因为结构中含____(填官能团名称)。
(3)向肉桂酸溶液中滴加NaHCO3溶液,实验现象为____。
(4)写出肉桂酸与乙醇发生酯化反应的化学方程式:____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】新型材料B4C可用于制作切削工具和高温热交换器。关于B4C的推断正确的是
A. B4C是一种分子晶体B. B4C是该物质的分子式
C. B4C是一种原子晶体D. B4C的电子式为![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,某同学设计一个燃料电池并探究氯碱工业原理和粗铜的精炼原理, 其中乙装置中 X 为阳离子交换膜。

根据要求回答相关问题:
(1)写出负极的电极反应式_____
(2)写出石墨电极的电极反应式_____________
(3)反应一段时间后,乙装置中生成氢氧化钠主要在_________(填“铁极”或“石墨极”)区。
(4)如果粗铜中含有锌、银等杂质,丙装置中阳极上电极反应式为_________,反应一段时间,硫酸铜溶液浓度将_____(填“增大”“减小”或“不变”)。
(5)若在标准状况下,有 2.24 L 氧气参加反应,则乙装置中铁电极上生成的气体的分子数目为_____;丙装置中阴极析出铜的质量为_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:CO和H2在Co做催化剂、温度为160℃~200℃时,可以合成汽油(即分子中含5至8个碳原子的烷烃).
(1)用CnH2n+2表示汽油,写出上述反应的化学方程式_______(需配平)
(2)若向密闭的合成塔内通入CO和H2,恰好完全反应,此时塔内压强降至反应前的![]() ,通过计算说明是否生成汽油______________________.
,通过计算说明是否生成汽油______________________.
(3)以天然气、焦炭、水为初始原料,可以制得CO和H2,进而人工合成汽油.(流程示意图如下,反应③的H2也由反应①得到.)
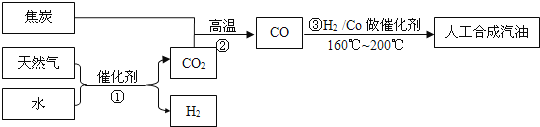
若反应①、②、③的转化率均为100%,且将反应①中得到的CO2和H2全部用于合成人工汽油.
(a)通过计算说明上述方案能否得到理想的产品________________.
(b)当CO2的使用量应控制为反应①中CO2产量的_____(填比例范围),可以得到理想的产品.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某兴趣小组为研究碳酸钠水解平衡与温度的关系,用数字试验系统测定一定浓度碳酸钠溶液的pH与温度的关系,得到曲线如图,下列分析不合理的是( )
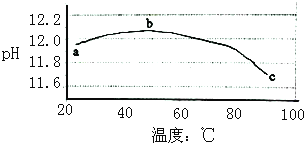
A.碳酸钠水解是吸热反应
B.ab段说明水解平衡向右移动
C.bc段说明水解平衡向左移动
D.水的电离平衡也对pH产生影响
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某兴趣小组为研究上述反应中钾元素的熔出率(液体中钾元素的质量占样品质量的百分率)与温度的关系,进行实验(保持其它条件不变),获得数据曲线如图。
主要反应是:NaCl(l)+KAlSi3O8(s)KCl(l)+NaAlSi3O8(s)+Q;
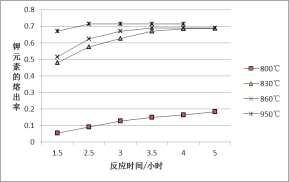
(1)分析数据可知,Q_______0(选填“>”或“<”)。
(2)950℃时,欲提高钾的熔出速率可以采取的措施是_______(填序号)。
a.延长反应时间 b.充分搅拌
c.增大反应体系的压强 d.将钾长石粉粹成更小的颗粒
(3)要使钾元素的熔出率和熔出速率都达到最大,反应温度应为_____________。
(4)工业上常用KCl冶炼金属钾。反应方程式为:Na(l)+KCl(l)![]() NaCl(l)+K(g)用平衡移动原理解释该方法可行的原因:_________________。
NaCl(l)+K(g)用平衡移动原理解释该方法可行的原因:_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种香豆素的衍生物结构如图所示,关于该有机物说法正确的是( )
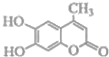
A.该有机物分子式为 C10H10O4
B.1mol该有机物与 H2发生加成时最多消耗H2 5 mol
C.1mol该有机物与足量溴水反应时最多消耗Br23 mol
D.1mol该有机物与 NaOH 溶液反应是最多消耗NaOH 3 mol
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com