
【题目】下列反应的离子方程式书写正确的是
A. 惰性电极电解氯化镁溶液:2Cl-+2H2O![]() Cl2↑+H2↑+2OH-
Cl2↑+H2↑+2OH-
B. 向CuSO4溶液中加入Na2O2:2Na2O2+2Cu2++2H2O=4Na++2Cu(OH)2↓+O2↑
C. 向NaClO和NaCl混合溶液中滴少量FeSO4溶液:2Fe2++ClO-+2H+=Cl-+2Fe3++H2O
D. 向KAl(SO4)2溶液中滴加Ba(OH)2溶液至沉淀物质的量最大:Al3++2SO42-+2Ba2++4OH-=[Al(OH)4]-+2BaSO4↓
【答案】B
【解析】A.惰性电极电解氯化镁溶液的离子反应方程式为Mg2+ + 2Cl-+2H2O![]() Cl2↑+H2↑+2 Mg(OH)2↓,故A错误;B.将Na2O2放入CuSO4溶液中,Na2O2先与水发生的反应应为:Na2O2+2H2O=4Na++4OH-+O2↑,生成的NaOH再与CuSO4溶液反应,生成Cu(OH)2↓,总的离子方程式2Na2O2+2Cu2++2H2O=4Na++2Cu(OH)2↓+O2↑,B正确;C、该溶液中,应该是碱性条件下,故C错误;D.沉淀物质的量最大,就是铝离子恰好沉淀完全,参加反应的KAl(SO4)2与Ba(OH)2的物质的量之比为2:3,方程式为: 2KAl(SO4)2+3Ba(OH)2==2Al(OH)3↓+3BaSO4↓+K2SO4,离子方程式:2Al3+ + 3SO42- + 3Ba2+ + 6OH- == 2Al(OH)3↓ + 3BaSO4↓,D错误。
Cl2↑+H2↑+2 Mg(OH)2↓,故A错误;B.将Na2O2放入CuSO4溶液中,Na2O2先与水发生的反应应为:Na2O2+2H2O=4Na++4OH-+O2↑,生成的NaOH再与CuSO4溶液反应,生成Cu(OH)2↓,总的离子方程式2Na2O2+2Cu2++2H2O=4Na++2Cu(OH)2↓+O2↑,B正确;C、该溶液中,应该是碱性条件下,故C错误;D.沉淀物质的量最大,就是铝离子恰好沉淀完全,参加反应的KAl(SO4)2与Ba(OH)2的物质的量之比为2:3,方程式为: 2KAl(SO4)2+3Ba(OH)2==2Al(OH)3↓+3BaSO4↓+K2SO4,离子方程式:2Al3+ + 3SO42- + 3Ba2+ + 6OH- == 2Al(OH)3↓ + 3BaSO4↓,D错误。


科目:高中化学 来源: 题型:
【题目】如图是实验室制SO2并验证SO2某些性质的装置图,试回答:

(1)⑥中发生反应的化学方程式为_____________________________________。
(2)①中实验现象为__________________,证明SO2是________气体。
(3)②中品红溶液_______________,证明SO2有________性。
(4)③中现象是____________________,证明SO2有________性。
(5)④中现象是____________________,证明SO2有________性。
(6)⑤的作用是_____________________,反应的化学方程式为____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以下是几种酸碱指示剂变色的pH范围:①甲基橙3.1~4.4②甲基红4.4~6.2③酚酞8.2~10.0,现用0.1000mol·L-1的NaOH溶液滴定浓度相近的乙酸时,上述指示剂( )
A.都可以用B.只能用③C.可以用①或②D.可以用②或③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】
有机物X、Y均为重要的工业原料,可由A和环己烯(![]() )为原料合成,路线如下(部分反应条件省略):
)为原料合成,路线如下(部分反应条件省略):

已知:ⅰ.X的结构简式是: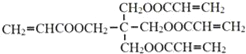
ⅱ.![]()
ⅲ.![]()
(1)X的化学式是____,A中含氧官能团的名称是_____;第①步反应的类型是___。
(2)下列有关说法正确的是_______。
a.H与苯酚可以用FeCl3溶液区分
b.G、H分别经一步反应都可得到环己烯
c.D的所有同分异构体在红外光谱仪中显示的信号(或数据)完全相同
d.试剂a是浓硫酸
e.反应②加高锰酸钾可以实现
(3)Y的结构简式是_____________________________________。
(4)已知1mo1W与1mol H2经加成反应生成1molE,写出W的同分异构体能同时满足下列条件的结构简式是_________________________________。
①能与饱和NaHCO3溶液反应产生气体
②既能发生银镜反应,又能发生水解反应
③核磁共振氢谱显示为3组峰,且峰面积比为6:1:1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】标准状况下有①6.72 L CH4 ②3.01×1023个HCl ③13.6 g H2S ④0.2 mol NH3,下列对四种气体的关系表示不正确的是
A. 体积④<①<③<② B. 密度①<④<③<②
C. 质量④<①<③<② D. 氢原子数④<②<③<①
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,纯水中的c(H+)=2.0×10-7mol/L,此时溶液的c(OH-)=_______mol/L;若温度不变,滴入稀盐酸使c(H+)=5.0×10-4mol/L,则溶液中c(OH-)=________mol/L,由水电离产生的c(H+)=_______mol/L,此时温度_______25℃(填“高于”、“低于”或“等于”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)银作为催化剂,主要用于乙烯氧化制环氧乙烷、甲醇氧化制甲醛等。目前银催化剂的市场需求呈逐年增加的趋势。请写出甲醇在银催化下制备甲醛的化学方程式
________________________________________________________________。
(2)银催化剂在使用过程中,催化活性逐渐减弱、选择性降低,一定时间后必须更换。某工厂对失效银催化剂进行回收并实现再生,工艺流程如下:

已知:银催化剂主要成分(X射线荧光光谱法分析)
元素 | Al2O3 | Ag | MgO | SiO2 | K2O | Fe2O3 |
含量% | 82 | 14.8 | 1.4 | 0.9 | 0.5 | 0.1 |
资料:经X射线衍射仪检测,其中氧化铝的晶型为α型,难于酸。
①操作a和操作b的名称是_________。
②请写出过程Ⅰ中银与稀硝酸反应的离子方程式
________________________________________________________________。
(3)滤液2 中含有多种金属离子,请简述检验其中K+的实验方法
____________________________________________________________________。
(4)结合化学用语从平衡移动角度解释过程Ⅲ中用氨水将氯化银沉淀溶解的原
因_______________________________________________________________。
(5)过程Ⅳ采用肼(N2H4)作为还原剂,具有不混入金属杂质、还原性强、得到银纯度高等优点,该过程的化学方程式为:
________________________________________________________。
(6)利用过程Ⅴ实现银催化剂再生,其简易装置图如下:

写出催化剂再生的电极反应式:________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关元素周期表中“周期”的说法错误的是
A. 元素周期表中有四个长周期、三个短周期
B. 同一周期主族元素原子的核外电子层数相同
C. 同一周期主族元素原子的价电子数目不同
D. 元素周期表中每个周期均从金属元素开始,以非金属元素结束
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com