
下列说法不正确的是( )
A.C2H4和HCN分子中,都含σ键和π键,但C原子的杂化方式并不相同
B.在元素周期表中,p区元素的最外层电子排布均可表示为ns2np1~6
C.某基态原子的核外电子排布图为 ,它违背了泡利不相容原理
,它违背了泡利不相容原理
D.用红外光谱可鉴别乙醇和二甲醚,用X-射线衍射实验可鉴别玻璃与水晶
科目:高中化学 来源: 题型:
某同学设计如下图所示原电池(盐桥中装有含琼胶的KCl饱和溶液)。
该电池工作时,下列说法正确的是
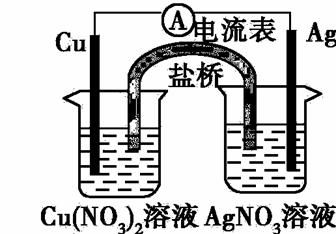
A.盐桥中的K+ 移向AgNO3溶液
B.负极反应为:Ag –e— =Ag+
C.该装置可将电能转化为化学能
D.在外电路中,电子由银电极流向铜电极
查看答案和解析>>
科目:高中化学 来源: 题型:
 A、B、C、D、E属于短周期元素,原子序数依次增大,已知A 与E同主族,B、C、D、E同周期,A与B可形成两种离子化合物甲和乙,在甲中A、B 离子的电子层结构相同;C的简单离子半径是同周期所有离子中最小的,高纯度的D单质可制造芯片;又知 C、D的单质都能与强碱溶液反应。
A、B、C、D、E属于短周期元素,原子序数依次增大,已知A 与E同主族,B、C、D、E同周期,A与B可形成两种离子化合物甲和乙,在甲中A、B 离子的电子层结构相同;C的简单离子半径是同周期所有离子中最小的,高纯度的D单质可制造芯片;又知 C、D的单质都能与强碱溶液反应。
(1)写出: A D (元素符号),乙 (化学式)。
(2)E元素在周期表中的位置是第 周期,第 族。
(3)画出B的原子结构示意图 ;
(4)C单质与NaOH溶液反应的离子方程式 ;
(5)举出C单质在工业上的一种重要用途(必须用化学方程式表示) 。
查看答案和解析>>
科目:高中化学 来源: 题型:
CO2、BF3、CCl4都是非极性分子,NH3、H2S都是极性分子,由此推出ABn型分子是非极性分子的经验规律,正确的是( )
A.所有原子在同一平面内 B.分子中不含有氢原子
C.A的化合价的数值等于其最外层电子数 D.分子结构对称
查看答案和解析>>
科目:高中化学 来源: 题型:
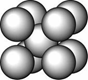
有关晶体的结构如图所示,下列说法中不正确的是 ( )
A.在NaCl晶体(图甲)中,距Na+最近的Cl-形成正八面体
B.该气态团簇分子(图乙)的分子式为E4F4或F4E4
C.在SiO2晶体(图丙)中,1molSi原子最多可形成4molSi-O键
D.单质锌采取六方最密堆积(图丁),配位数为8

甲 乙 丙 丁
查看答案和解析>>
科目:高中化学 来源: 题型:
某金属晶体M有两种堆积形式,如下图甲和乙,在T℃以上时甲可以转变为乙,这两种结构中最邻近的原子间距离相同。

甲 乙
(1)乙的堆积方式称为 堆积;
甲和乙两种堆积方式中配位数之比为 ,晶胞边长之比为 。
(2)在T℃以下测定该金属晶体有关性质参数如下表所示。已知原子化热指1mol金属由固态转变为气态原子时所需要吸收的热量,是衡量金属键强弱的物理量。
| 金属 | 相对原子质量 | 密度/g·㎝-3 | 原子化热/kJ·mol-1 |
| Na | 22. 99 | 0. 960 | 108. 4 |
| M | 60. 20 | 7. 407 | 7735 |
预测该金属的熔点比Na (填“高”或“低”),由上述数据可计算M原子的原子半径为 pm。
(已知 ,7. 407≈
,7. 407≈ ,1pm=10
,1pm=10 m)
m)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com