
等体积等物质的量浓度的下列溶液与足量的铝充分反应,相同条件下,放出氢气的体积最大的是
A.氢氧化钠溶液 B.稀硫酸 C.盐酸 D.稀硝酸
 活力课时同步练习册系列答案
活力课时同步练习册系列答案科目:高中化学 来源: 题型:
(1)配平氧化还原反应方程式:
C2O +____MnO
+____MnO +____H+===____CO2↑+____Mn2++____H2O
+____H+===____CO2↑+____Mn2++____H2O
(2)称取6.0 g含H2C2O4·2H2O、KHC2O4和K2SO4的试样,加水溶解,配成250 mL溶液。量取两份此溶液各25.00 mL,分别置于两个锥形瓶中。
①第一份溶液中加入酚酞试液,滴加0.25 mol·L-1 NaOH溶液至20.00 mL时,溶液由无色变为浅红色。该溶液被中和的H+的总物质的量为________mol。
②第二份溶液中滴加0.10 mol·L-1的酸性高锰酸钾溶液。
A.KMnO4溶液在滴定过程中作________(填“氧化剂”或“还原剂”),该滴定过程________(填“需要”或“不需要”)另加指示剂。滴至16.00 mL时反应完全,此时溶液颜色由________变为__________。
B.若在接近终点时,用少量蒸馏水将锥形瓶冲洗一下,再继续滴定至终点,则所测结果__________(填“偏大”、“偏小”或“无影响”)。
C.若在达到滴定终点时俯视读数,则所得结果________(填“偏大”、“偏小”或“无影响”)。
③原试样中H2C2O4·2H2O的质量分数为________,KHC2O4的质量分数为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
在恒容密闭容器中存在下列平衡:


 。
。 的平衡物质的量浓度
的平衡物质的量浓度 与温度T的关系如右图所示。下列说法错误的是
与温度T的关系如右图所示。下列说法错误的是
A.反应

 的
的
B.在 时,若反应处于状态
时,若反应处于状态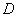 ,则一定有v(逆)>v(正)
,则一定有v(逆)>v(正)
C.平衡状态 与
与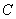 相比,平衡状态
相比,平衡状态 的
的 小
小
D.若 时的平衡常数分别为
时的平衡常数分别为 ,则
,则

查看答案和解析>>
科目:高中化学 来源: 题型:
下列实验的现象、解释或结论正确的是 ( )
| 选项 | 实验 | 解释或结论 |
| A | 向某溶液中逐渐通入CO2气体,先出现白色胶状沉淀,继续通入CO2气体,白色胶状沉淀不溶解,证明该溶液中存在 | Al(OH)3是两性氢氧化物,不溶于碳酸溶液 |
| B | 在新制氯水中加入碳酸钙粉末,充分搅拌,氯水的漂白性增强 | 氯水中HClO的物质的量浓度增大 |
| C | 用蒸馏法能将溶解在CCl4中的碘分离出来 | 因为碘易升华,先分离出来 |
| D | 向Fe(NO3)2溶液中滴入硫酸酸化的H2O2溶液,则溶液变为黄色 | 氧化性:H2O2>Fe3+ |
查看答案和解析>>
科目:高中化学 来源: 题型:
四种短周期元素A、B、C、D的原子序数依次递增.其中A、B、C二种元素基态原子的2p能级上都有未成对电子.且未成对电子个数分别是2、3、2;D与C 可以形成D2C和D2C2两种化合物。回答下列问题:
(1)已知A元素与氢元素形成的某种气态化合物在标准状况下的密度为1.1 6 1 g·L-1,则在该化合物的分子中A原子的杂化方式为 。
(2)A、B、C二种元素的第一电离能由小到大的顺序为 (填元素符号)。
 (3)+1价气态基态阳离子再失去一个电子形成+2价气态基态阳离子
(3)+1价气态基态阳离子再失去一个电子形成+2价气态基态阳离子
所需要的能量称为第二电离能I2,依次还有I3、I4、I5……,推测D元素
的电离能第一次突增应出现在第 电离能。
(4)AC2在高温高压下所形成的晶体其晶胞如图1所示。
该晶体的类型属于 晶体.该品体中A原子轨道的
杂化类型为 。
(5)A和C形成原子个数比为1:3的常见离子.推测这种微粒的空间
 构型为 。
构型为 。
(6)C和D形成的一种离子化合物D2C的晶胞结构如图2所示.该晶体
中阳离子的配位数为 。距一个阴离子周围最近的所有阳离子为顶点
构成的几何体为 。已知该晶胞的密度为ρg·cm-3,阿伏加德罗常数为NA.
则晶胞边长a= cm(用含ρ、NA的代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
已知反应X+Y= M+N为吸热反应,对这个反应的下列说法中正确的是( )
A、X的能量一定低于M的,Y的能量一定低于N的
B、因为该反应为吸热反应,故一定要加热反应才能进行
C、破坏反应物中的化学键所吸收的能量小于形成生成物中化学键所放出的能量
D、X和Y的总能量一定低于M和N的总能量
查看答案和解析>>
科目:高中化学 来源: 题型:
230Th和232Th是钍的两种同位素,232Th可以转化成233U。下列有关Th的说法正确的是
A. Th 元素的质量数是232 B. Th 元素的相对原子质量是231
C. 230Th和232Th的性质相同 D. 230Th和232Th的化学性质相同
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法不正确的是( )
A.C2H4和HCN分子中,都含σ键和π键,但C原子的杂化方式并不相同
B.在元素周期表中,p区元素的最外层电子排布均可表示为ns2np1~6
C.某基态原子的核外电子排布图为 ,它违背了泡利不相容原理
,它违背了泡利不相容原理
D.用红外光谱可鉴别乙醇和二甲醚,用X-射线衍射实验可鉴别玻璃与水晶
查看答案和解析>>
科目:高中化学 来源: 题型:
已知室温下,Al(OH)3的Ksp或溶解度远大于Fe(OH)3。向浓度均为0.1 mol·L-1的Fe(NO3)3和Al(NO3)3混合溶液中,逐滴加入NaOH溶液。下列示意图表示生成Al(OH)3的物质的量与加入NaOH溶液的体积的关系,合理的是 ( )


查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com