
【题目】2019年诺贝尔化学奖授予三位化学家,以表彰其对研究开发锂离子电池作出的卓越贡献。LiFePO4、聚乙二醇、LiPF6、LiAsF6和LiCl等可作锂离子聚合物电池的材料。回答下列问题:
(1)Fe的价层电子排布式为___。
(2)Li、F、P、As四种元素的电负性由大到小的顺序为___。
(3)乙二醇(HOCH2CH2OH)的相对分子质量与丙醇(CH3CH2CH2OH)相近,但沸点高出100℃,原因是___。
(4)电池工作时,Li+沿聚乙二醇分子中的碳氧链迁移的过程如图甲所示(图中阴离子未画出)。电解质LiPF6或LiAsF6的阴离子结构如图乙所示(X=P、As)。
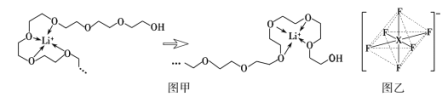
①聚乙二醇分子中,碳、氧的杂化类型分别是___、___。
②从化学键角度看,Li+迁移过程发生___(填“物理变化”或“化学变化”)。
③PF6中P的配位数为___。
④相同条件,Li+在___(填“LiPF6”或“LiAsF6”)中迁移较快,原因是___。
(5)以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子分数坐标。LiCl·3H2O属正交晶系(长方体形)。晶胞参数为0.72nm、1.0nm、0.56nm。如图为沿x轴投影的品胞中所有Cl原子的分布图和原子分数坐标。据此推断该晶胞中Cl原子的数目为___。LiCl·3H2O的摩尔质量为Mg·mol-1,设NA为阿伏加德罗常数的值,则LiCl·3H2O晶体的密度为___g·cm-3(列出计算表达式)。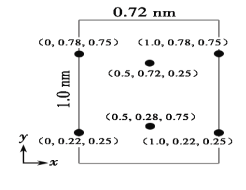
【答案】3d64s2 F、P、As、Li 乙二醇分子中羟基比丙醇的多,分子间的氢键比丙醇多,分子间作用力较大 sp3 sp3 化学变化 6 LiAsF6 AsF6-的半径比PF6-的大,AsF6-与Li+的作用力比PF6-弱 4 ![]()
【解析】
(1)Fe为26号元素,核外电子排布式为1s22s22p63s23p63d64s2;
(2)非金属性越强,电负性越强;
(3)根据氢键的数量分析判断;
(4)①根据图中聚乙二醇的碳氧键链方式分析判断杂化轨道类型;
②化学变化过程是旧键的断裂和新键的形成;
③与中心原子直接以配位键相结合的原子个数即为配位数;
④相同条件,AsF6-的半径比PF6-的大,对锂离子的作用力大小不同;
(5)根据晶胞密度公式计算;
(1)Fe为26号元素,核外电子排布式为1s22s22p63s23p63d64s2,故价层电子排布式为3d64s2;
(2)非金属性越强,电负性越强,非金属性:F>P>As>Li,则四种元素的电负性由大到小的顺序为F、P、As、Li;
(3)乙二醇分子中羟基比丙醇的多,分子间的氢键比丙醇多,分子间作用力较大;
(4)①图中聚乙二醇的碳原子都是形成4个单键,无孤电子对,为sp3杂化,氧原子都是形成2个单键,有2对孤电子,为sp3杂化;
②化学变化过程的实质是旧键的断裂和新键的形成,Li+在迁移过程中要将旧的配位键断裂,迁移后再形成新的配位键,符合化学变化过程的要求;
③与中心原子直接以配位键相结合的原子个数即为配位数,由图乙所示,PF6的中心原子为P,与之以配位键相结合的F原子有6个,则配位数为6;
④AsF6-的半径比PF6-的大,AsF6-与Li+的作用力比PF6-弱,则Li+在LiAsF6中迁移较快;
(5)如图为沿x轴投影的品胞中所有Cl原子的分布图和原子分数坐标。其中2个Cl原子在晶胞内部,4个Cl在晶胞的面上,则该晶胞中Cl原子的数目为2+4×![]() =4个;晶胞参数为0.72nm、1.0nm、0.56nm。则晶胞的体积为0.72nm×1.0nm×0.56nm=(0.72×1.0×0.56)nm3=(0.72×1.0×0.56×10-21)cm3,晶胞中含有4个Cl原子,即含有4个LiCl·3H2O,则晶胞的质量为
=4个;晶胞参数为0.72nm、1.0nm、0.56nm。则晶胞的体积为0.72nm×1.0nm×0.56nm=(0.72×1.0×0.56)nm3=(0.72×1.0×0.56×10-21)cm3,晶胞中含有4个Cl原子,即含有4个LiCl·3H2O,则晶胞的质量为![]() g,则LiCl·3H2O晶体的密度为
g,则LiCl·3H2O晶体的密度为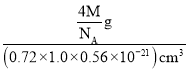 =
=![]() g·cm-3。
g·cm-3。


科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A.![]() 与
与![]() 互为同位素
互为同位素
B.O2和O3互为同素异形体,两者之间不能相互转化
C.乙醇和甲醚互为同分异构体,可用金属钠鉴别
D.![]() 的一氯代物只有2种(不考虑立体异构)
的一氯代物只有2种(不考虑立体异构)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应2H2(g)+02(g)=2H2O(l)过程中的能量变化如图所示,下列有关说法中正确的是

A. H1<0 B. H2为该反应的反应热
C. H3为氢气的燃烧热 D. H1=H3-H2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上常用电解硫酸钠溶液联合生产硫酸和烧碱,生产装置如图所示,其中阴极和阳极均为惰性电极。测得同温同压下,气体甲与气体乙的体积比约为1∶2,以下说法中正确的是( )
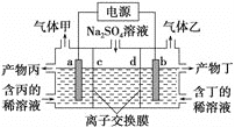
A. a极与电源的负极相连
B. 产物丁为硫酸溶液
C. 离子交换膜d为阳离子交换膜
D. b电极反应式:4OH--4e- =O2↑+2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室欲用NaOH固体配制1.0 mol/L的NaOH溶液480 mL:
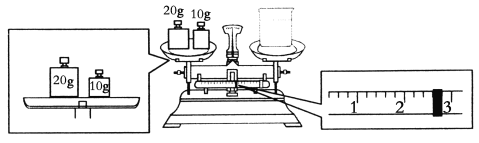
(1)配制时,必须使用的玻璃仪器有胶头滴管、烧杯、玻璃棒、________。
(2)要完成本实验该同学应称出NaOH________g。
(3)某同学欲称量NaOH的质量,他先用托盘天平称量烧杯的质量,天平平衡后的状态如图,烧杯的实际质量为________g。
(4)使用容量瓶前必须进行的一步操作是________。
(5)在配制过程中,其他操作都是正确的,下列操作会引起误差偏高的是________。
①没有洗涤烧杯和玻璃棒
②转移溶液时不慎有少量洒到容量瓶外面
③容量瓶不干燥,含有少量蒸馏水
④定容时俯视刻度线
⑤未冷却到室温就将溶液转移到容量瓶并定容
⑥定容后塞上瓶塞反复摇匀,静置后,液面低于刻度线,再加水至刻度线
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学生用0.2000mol·L-1的标准NaOH溶液滴定未知浓度的盐酸,其操作为如下几步:
①用蒸馏水洗涤碱式滴定管,并立即注入NaOH溶液至“0”刻度线以上
②固定好滴定管并使滴定管尖嘴充满液体
③调节液面至“0”或“0”刻度线稍下,并记下读数
④移取20.00 mL待测液注入洁净的锥形瓶中,并加入3滴酚酞溶液
⑤用标准液滴定至终点,记下滴定管液面读数
请回答:
(1)以上步骤有错误的是_____,该错误操作会导致测定结果___________
(2)判断滴定终点的现象是:________________________________________
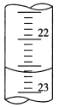
(3)如图是某次滴定时的滴定管中的液面,其读数为_______ mL。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】奥司他韦是一种高效、高选择性神经氨酸酶抑制剂,是目前治疗流感的最常用药物之一,是公认的抗禽流感、甲型H1N1等病毒最有效的药物之一。也是国家的战略储备药物。也有专家尝试使用奥司他韦作为抗新型冠状病毒(2019-nCoV)药物。以莽草酸作为起始原料是合成奥司他韦的主流路线。
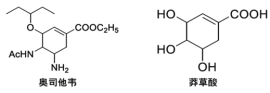
Ⅰ.莽草酸是从中药八角茴香中提取的一种化合物,是合成奥司他韦的原料。下列有关莽草酸说法正确的是__
A 不能使酸性高锰酸钾溶液褪色
B 可以发生加成反应、消去反应、加聚反应、缩聚反应、取代反应
C 分子中所有原子共平面
D 只溶于苯等有机溶剂,不溶于水
Ⅱ.奥司他韦的合成路线如下:
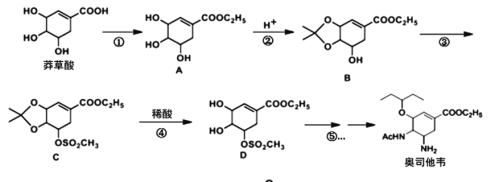
已知:![]()
回答下列问题:
(1)化合物A的含氧官能团名称有:_______,反应③的反应类型:____。
(2)反应①的反应试剂和反应条件:____。
(3)请写出反应②的化学方程式:____。
(4)芳香化合物X是B的同分异构体,则符合官能团只含酚羟基的X有__种。
(5)碳原子上连有4个不同的原子或基团时,该碳称为手性碳。C中有__个手性碳。
(6)结合以上合成路线设计由对甲基苯甲醛制备对醛基苯甲酸![]() 的合成路线____。
的合成路线____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA代表阿伏加德罗常数的数值,下列说法中正确的是( )
A.常温下1L0.1mol·L-1NH4NO3溶液中的氮原子数为0.2NA
B.在熔融状态下,lmolNaHSO4完全电离出的阳离子数目为2NA
C.22.4L氯气与足量的金属铁发生氧化还原反应时得到2NA个电子
D.常温常压下,18g重水(D2O)所含的中子数为10NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物F(盐酸地拉普利)是一种治疗高血压的药物,其合成路线流程图如图:
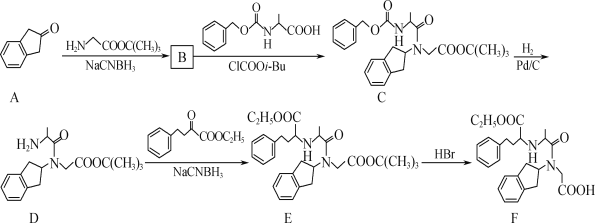
(1)D中的官能团有酰胺键、__和__(填名称)。
(2)E→F的反应类型为__。
(3)B的分子式为C15H21O2N,写出B的结构简式:__。
(4)A的一种同分异构体M同时满足下列条件,写出M的结构简式:___。
①M是一种芳香族化合物,能与NaOH溶液发生反应;
②M分子中有4种不同化学环境的氢。
(5)已知:R—X![]() R—CN
R—CN![]() R—CH2NH2。
R—CH2NH2。
写出以![]() 为原料制备
为原料制备![]() 的合成路线流程图(无机试剂任选,合成路线流程图示例见本题题干)___。
的合成路线流程图(无机试剂任选,合成路线流程图示例见本题题干)___。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com