
| A、2 min末时,A和B的浓度之比为5:3 |
| B、x=1 |
| C、2 min末时,B的浓度为1.5 mol?L-1 |
| D、2 min末时,A的消耗浓度为0.5 mol?L-1 |
| 0.5x |
| 2min |
| 0.5x |
| 2min |


 培优好卷单元加期末卷系列答案
培优好卷单元加期末卷系列答案科目:高中化学 来源: 题型:
| A、50mL 0.1mol/L FeCl3溶液 |
| B、200mL 0.4mol/L NaCl溶液 |
| C、200mL 0.1mol/L MgCl2溶液 |
| D、200mL 0.2mol/L KCl溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、英国科学家道尔顿发现了元素周期律 |
| B、研究物质性质的基本方法有实验法、观察法、分类法、比较法 |
| C、化学的特征是认识分子和制造分子 |
| D、我国科学家合成的结晶牛胰岛素是世界上首次人工合成的具有生物活性的蛋白质 |
查看答案和解析>>
科目:高中化学 来源: 题型:
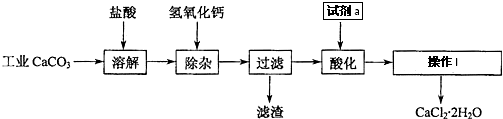
查看答案和解析>>
科目:高中化学 来源: 题型:
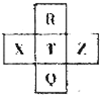 元素R、X、T、Z、Q在元素周期表中的相对位置如图所示,其中X单质与Na单质的固体研磨发生爆炸.则下列判断不正确的是( )
元素R、X、T、Z、Q在元素周期表中的相对位置如图所示,其中X单质与Na单质的固体研磨发生爆炸.则下列判断不正确的是( )| A、原子半径:R<T<X,非金属性:Z<X<T |
| B、R与Q原子的电子数相差26,属于VIIA族即卤族元素 |
| C、简单阴离子的半径:X>T,气态氢化物稳定性:R<T<Q |
| D、最高价氧化物对应水化物的酸性:T>X、T>Q |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、标准状况下,22.4L水所含的分子数为NA | ||||
| B、17g NH3中所含的原子个数为4NA | ||||
| C、1L、1mol/L的稀盐酸中含有的氯化氢分子数为NA | ||||
D、在反应2H2O2
|
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、水电离出的H+的浓度是1.0×10-4mol?L-1 |
| B、溶液中离子浓度:c(HSO3-)>c(SO32-)>c(H2SO3) |
| C、溶液中离子浓度:c(Na+)=c(HSO3-)+2c(SO32-)+c(H2SO3) |
| D、溶液中离子浓度:c(H+)+c(SO32-)=c(OH-)+c(H2SO3) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、摩尔是国际上规定的七个基本物理量之一 |
| B、不同的气体,若体积不等,则它们所含的分子数一定不等 |
| C、一定温度、压强下,各种气态物质分子间距离近似相等 |
| D、气体的摩尔体积为22.4L/mol |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com