
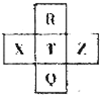
 元素R、X、T、Z、Q在元素周期表中的相对位置如图所示,其中X单质与Na单质的固体研磨发生爆炸.则下列判断不正确的是( )
元素R、X、T、Z、Q在元素周期表中的相对位置如图所示,其中X单质与Na单质的固体研磨发生爆炸.则下列判断不正确的是( )| A、原子半径:R<T<X,非金属性:Z<X<T |
| B、R与Q原子的电子数相差26,属于VIIA族即卤族元素 |
| C、简单阴离子的半径:X>T,气态氢化物稳定性:R<T<Q |
| D、最高价氧化物对应水化物的酸性:T>X、T>Q |


 轻松课堂单元期中期末专题冲刺100分系列答案
轻松课堂单元期中期末专题冲刺100分系列答案科目:高中化学 来源: 题型:
| A、由H+(aq)+OH-(aq)=H20(1)△H=-57.3 kJ?mol-1,可知含1 mo1 CH3COOH的溶液与含1 mol NaOH的溶液混合,放出热量为57.3 kJ |
| B、由C(石墨)=C(金刚石)△H=+1.9 kJ?mol-1,可知石墨比金刚石更稳定 |
| C、由N2(g)+3H2(g)=2NH3(g)△H=-92.4 kJ?mol-1,可知将1 mol N2(g)和3 mol H2(g)置于密闭容器中充分反应后放出热量为92.4 kJ |
| D、由△G=△H-T△S可知,所有的放热反应都能自发进行 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、18 g水所含分子数目为NA |
| B、17 g NH3所含氢原子数目为NA |
| C、标准状况下,2.24L O2所含的原子数为0.2NA |
| D、2.4 g金属镁所含电子数目为0.2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、②③ | B、②④⑤ |
| C、①②⑤ | D、②④ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、电子层结构相同的微粒,其化学性质一定相似 |
| B、第三周期非金属元素含氧酸的酸性从左到右依次增强 |
| C、非金属元素的原子两两结合形成的化合物不一定是共价化合物 |
| D、元素周期律是元素原子核外电子排布周期性变化的结果 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、2 min末时,A和B的浓度之比为5:3 |
| B、x=1 |
| C、2 min末时,B的浓度为1.5 mol?L-1 |
| D、2 min末时,A的消耗浓度为0.5 mol?L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、2 L溶液中阴、阳离子总数为0.8 NA |
| B、500 mL溶液中NO3-浓度为0.4 mol?L-1 |
| C、500 mL溶液中Ba2+浓度为0.2 mol?L-1 |
| D、500 mL溶液中NO3-总数为0.2 NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com