
| A、2 L溶液中阴、阳离子总数为0.8 NA |
| B、500 mL溶液中NO3-浓度为0.4 mol?L-1 |
| C、500 mL溶液中Ba2+浓度为0.2 mol?L-1 |
| D、500 mL溶液中NO3-总数为0.2 NA |


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
| 序号 | 反应物 | 产物 |
| ① | KMnO4、H2O2、H2SO4 | K2SO4、MnSO4… |
| ② | Cl2、FeBr2 | FeCl3、FeBr3 |
| ③ | MnO4-… | Cl2、Mn2+… |
| A、第①组反应的其余产物只有O2 |
| B、第②组反应中Cl2与FeBr2的物质的量之比为1:2 |
| C、第③组反应中生成1molCl2,转移电子10mol |
| D、氧化性由强到弱顺序为MnO4->Cl2>Fe3+>Br2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
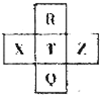 元素R、X、T、Z、Q在元素周期表中的相对位置如图所示,其中X单质与Na单质的固体研磨发生爆炸.则下列判断不正确的是( )
元素R、X、T、Z、Q在元素周期表中的相对位置如图所示,其中X单质与Na单质的固体研磨发生爆炸.则下列判断不正确的是( )| A、原子半径:R<T<X,非金属性:Z<X<T |
| B、R与Q原子的电子数相差26,属于VIIA族即卤族元素 |
| C、简单阴离子的半径:X>T,气态氢化物稳定性:R<T<Q |
| D、最高价氧化物对应水化物的酸性:T>X、T>Q |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、水电离出的H+的浓度是1.0×10-4mol?L-1 |
| B、溶液中离子浓度:c(HSO3-)>c(SO32-)>c(H2SO3) |
| C、溶液中离子浓度:c(Na+)=c(HSO3-)+2c(SO32-)+c(H2SO3) |
| D、溶液中离子浓度:c(H+)+c(SO32-)=c(OH-)+c(H2SO3) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、28g氮气所含有的氮原子数目为NA |
| B、1mol铁与足量氯气反应转移电子数目为3NA |
| C、标准状况下,22.4L水中含有的水分子数目为NA |
| D、1mol?L-1 K2SO4溶液中含有的钾离子数目为2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、摩尔是国际上规定的七个基本物理量之一 |
| B、不同的气体,若体积不等,则它们所含的分子数一定不等 |
| C、一定温度、压强下,各种气态物质分子间距离近似相等 |
| D、气体的摩尔体积为22.4L/mol |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、向Fe2(SO4)3溶液中滴入KSCN溶液:Fe3++3SCN-?Fe(SCN)3↓ |
| B、向NaHCO3溶液中滴加少量Ca(OH)2溶液:Ca2++OH-+HCO3-=CaCO3↓+H2O |
| C、向NaHSO4溶液中滴加Ba(OH)2溶液至呈中性:2H++SO42-+Ba2++2OH-=2H2O+BaSO4↓ |
| D、用KIO3氧化酸性溶液中的KI:5I-+IO3-+3H2O=3I2+6OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、甲酸甲酯 | B、乙酸乙酯 |
| C、乙酸甲酯 | D、乙酸丙酯 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com