
| A、水电离出的H+的浓度是1.0×10-4mol?L-1 |
| B、溶液中离子浓度:c(HSO3-)>c(SO32-)>c(H2SO3) |
| C、溶液中离子浓度:c(Na+)=c(HSO3-)+2c(SO32-)+c(H2SO3) |
| D、溶液中离子浓度:c(H+)+c(SO32-)=c(OH-)+c(H2SO3) |
| 10-14 |
| 10-4 |


 励耘书业暑假衔接宁波出版社系列答案
励耘书业暑假衔接宁波出版社系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、②③ | B、②④⑤ |
| C、①②⑤ | D、②④ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、2 min末时,A和B的浓度之比为5:3 |
| B、x=1 |
| C、2 min末时,B的浓度为1.5 mol?L-1 |
| D、2 min末时,A的消耗浓度为0.5 mol?L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、标准状况下,22.4LH2含有的分子数为NA |
| B、常温常压下,10.6gNa2C03含有的Na+数为0.1NA |
| C、通常状况下,NA个C02分子占有的体积大于22.4L |
| D、物质的量浓度为1mol/L的MgCl2溶液中,含有Cl-个数为2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、2 L溶液中阴、阳离子总数为0.8 NA |
| B、500 mL溶液中NO3-浓度为0.4 mol?L-1 |
| C、500 mL溶液中Ba2+浓度为0.2 mol?L-1 |
| D、500 mL溶液中NO3-总数为0.2 NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
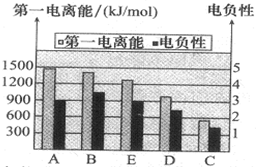 A、B、C、D、E是原子序数依次增大的五种短周期元素,其有关性质或结构信息如表所示:
A、B、C、D、E是原子序数依次增大的五种短周期元素,其有关性质或结构信息如表所示:| 元素 | A | B | C | D | E |
| 有关性质或结构信息 | 单质是空气中主要成分之一,其氢化物水溶液呈碱性 | 原子核外有两个未成对电子 | 日常生活中常见的金属,通常用电解法冶炼其单质 | 其简单阴离子带两个单位负电荷 | 单质有毒,常温下为有色气体,常用于自来水消毒 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com