
| A、电子层结构相同的微粒,其化学性质一定相似 |
| B、第三周期非金属元素含氧酸的酸性从左到右依次增强 |
| C、非金属元素的原子两两结合形成的化合物不一定是共价化合物 |
| D、元素周期律是元素原子核外电子排布周期性变化的结果 |


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
| A、标准状况下体积一定相同 |
| B、分子个数一定相同 |
| C、氧原子个数一定相同 |
| D、质量比是9:22 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 原子或分子相关信息 | 单质及其化合物相关信息 | |||
| X | ZX4分子是由粗Z提纯Z的中间产物 | X的最高价氧化物对应的水化物为无机酸中最强酸 | ||
| Y | Y原子的最外层电子数等于电子层数 | Y的氧化物是典型的两性氧化物,可用于制造一种极有前途的高温材料 | ||
| Z | Z原子的最外层电子数是次外层电子数的
| Z是无机非金属材料的主角,其单质是制取大规模集成电路的主要原料 | ||
| W | W原子的最外层电子数小于4 | W的常见化合价有+3、+2,WX3稀溶液呈黄色 |
查看答案和解析>>
科目:高中化学 来源: 题型:

| 1 |
| 2 |
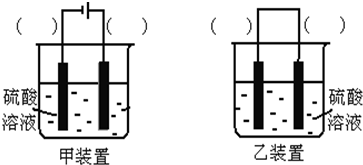
查看答案和解析>>
科目:高中化学 来源: 题型:
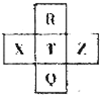 元素R、X、T、Z、Q在元素周期表中的相对位置如图所示,其中X单质与Na单质的固体研磨发生爆炸.则下列判断不正确的是( )
元素R、X、T、Z、Q在元素周期表中的相对位置如图所示,其中X单质与Na单质的固体研磨发生爆炸.则下列判断不正确的是( )| A、原子半径:R<T<X,非金属性:Z<X<T |
| B、R与Q原子的电子数相差26,属于VIIA族即卤族元素 |
| C、简单阴离子的半径:X>T,气态氢化物稳定性:R<T<Q |
| D、最高价氧化物对应水化物的酸性:T>X、T>Q |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、原子半径:C>D>B |
| B、元素B的气体氢化物的沸点比元素E气体氢化物的沸点高 |
| C、元素A的氧化物的大量排放能引起温室效应 |
| D、元素C、D、E的最高价氧化物对应的水化物两两之间能发生反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、28g氮气所含有的氮原子数目为NA |
| B、1mol铁与足量氯气反应转移电子数目为3NA |
| C、标准状况下,22.4L水中含有的水分子数目为NA |
| D、1mol?L-1 K2SO4溶液中含有的钾离子数目为2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com