
| 原子或分子相关信息 | 单质及其化合物相关信息 | |||
| X | ZX4分子是由粗Z提纯Z的中间产物 | X的最高价氧化物对应的水化物为无机酸中最强酸 | ||
| Y | Y原子的最外层电子数等于电子层数 | Y的氧化物是典型的两性氧化物,可用于制造一种极有前途的高温材料 | ||
| Z | Z原子的最外层电子数是次外层电子数的
| Z是无机非金属材料的主角,其单质是制取大规模集成电路的主要原料 | ||
| W | W原子的最外层电子数小于4 | W的常见化合价有+3、+2,WX3稀溶液呈黄色 |
| 1 |
| 2 |
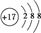 ,强酸与氧化铝反应,氧化铝变为铝离子,水不能拆,故离子反应方程式为:6H++Al2O3=2Al3++3H2O,故答案为:
,强酸与氧化铝反应,氧化铝变为铝离子,水不能拆,故离子反应方程式为:6H++Al2O3=2Al3++3H2O,故答案为: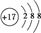 ;6H++Al2O3=2Al3++3H2O;
;6H++Al2O3=2Al3++3H2O;
| ||
| ||
| 1.56g |
| 78g/mol |
| 0.06mol |
| 0.5mol/L |
| 0.18mol |
| 0.5mol/L |


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
| A、氢氧化钡溶液与硫酸的反应:OH-+H+=H2O |
| B、碳酸钙溶于稀盐酸中:CaCO3+2H+=Ca2++H2O+CO2↑ |
| C、CH3COOH溶液与NH3?H2O溶液反应:H++OH-═H2O |
| D、澄清的石灰水与稀盐酸反应:Ca(OH)2+2H+=Ca2++2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、当反应中有一种元素被氧化时,一定有另一种元素被还原 |
| B、在化学反应中,得电子越多的氧化剂,其氧化性就越强 |
| C、阳离子只能得到电子被还原,阴离子只能失去电子被氧化 |
| D、含有最高价元素的化合物不一定具有很强的氧化性 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、18 g水所含分子数目为NA |
| B、17 g NH3所含氢原子数目为NA |
| C、标准状况下,2.24L O2所含的原子数为0.2NA |
| D、2.4 g金属镁所含电子数目为0.2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、K+、Fe2+、SO42-、Mg2+ |
| B、Na+、Cl-、NH4+、S2- |
| C、Al3+、Na+、Cl-、S2- |
| D、Na+、K+、Br-、Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、②③ | B、②④⑤ |
| C、①②⑤ | D、②④ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、电子层结构相同的微粒,其化学性质一定相似 |
| B、第三周期非金属元素含氧酸的酸性从左到右依次增强 |
| C、非金属元素的原子两两结合形成的化合物不一定是共价化合物 |
| D、元素周期律是元素原子核外电子排布周期性变化的结果 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Y、Z和W三种元素可能位于同一周期 |
| B、Y和W所形成的含氧酸均为强酸 |
| C、X、Y、Z和W可以组成原子的物质的量之比为5:1:4:1的离子化合物 |
| D、上述元素形成的氢化物中,W的氢化物相对分子质量最大,熔沸点最高 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com