
| A、Y、Z和W三种元素可能位于同一周期 |
| B、Y和W所形成的含氧酸均为强酸 |
| C、X、Y、Z和W可以组成原子的物质的量之比为5:1:4:1的离子化合物 |
| D、上述元素形成的氢化物中,W的氢化物相对分子质量最大,熔沸点最高 |


科目:高中化学 来源: 题型:
| 原子或分子相关信息 | 单质及其化合物相关信息 | |||
| X | ZX4分子是由粗Z提纯Z的中间产物 | X的最高价氧化物对应的水化物为无机酸中最强酸 | ||
| Y | Y原子的最外层电子数等于电子层数 | Y的氧化物是典型的两性氧化物,可用于制造一种极有前途的高温材料 | ||
| Z | Z原子的最外层电子数是次外层电子数的
| Z是无机非金属材料的主角,其单质是制取大规模集成电路的主要原料 | ||
| W | W原子的最外层电子数小于4 | W的常见化合价有+3、+2,WX3稀溶液呈黄色 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、28g氮气所含有的氮原子数目为NA |
| B、1mol铁与足量氯气反应转移电子数目为3NA |
| C、标准状况下,22.4L水中含有的水分子数目为NA |
| D、1mol?L-1 K2SO4溶液中含有的钾离子数目为2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、向Fe2(SO4)3溶液中滴入KSCN溶液:Fe3++3SCN-?Fe(SCN)3↓ |
| B、向NaHCO3溶液中滴加少量Ca(OH)2溶液:Ca2++OH-+HCO3-=CaCO3↓+H2O |
| C、向NaHSO4溶液中滴加Ba(OH)2溶液至呈中性:2H++SO42-+Ba2++2OH-=2H2O+BaSO4↓ |
| D、用KIO3氧化酸性溶液中的KI:5I-+IO3-+3H2O=3I2+6OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、甲酸甲酯 | B、乙酸乙酯 |
| C、乙酸甲酯 | D、乙酸丙酯 |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
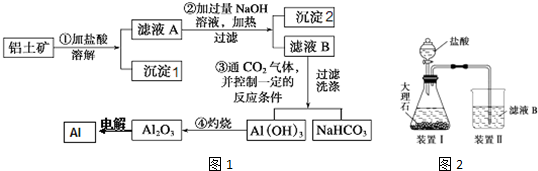
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com