

| Cu |
| △ |
 CH3COOC2H5+H2O,酯化反应或取代反应;
CH3COOC2H5+H2O,酯化反应或取代反应;| Cu |
| △ |


科目:高中化学 来源: 题型:
| A、电子层结构相同的微粒,其化学性质一定相似 |
| B、第三周期非金属元素含氧酸的酸性从左到右依次增强 |
| C、非金属元素的原子两两结合形成的化合物不一定是共价化合物 |
| D、元素周期律是元素原子核外电子排布周期性变化的结果 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、C12与FeI2溶液反应,当以n(C12):n(FeI2)=1:1时:2Fe2++2I-+2C12=2Fe3++I2+4Cl- |
| B、向Ba(NO3)2溶液中通入S02气体,出现白色沉淀:Ba2++SO2+H2O═BaSO3↓+2H+ |
| C、向H2O2 溶液中滴加酸化的KMnO4 溶液,KMnO4 溶液褪色:2MnO4?+7H2O2+6H+═2 Mn2++6O2↑+10H2O |
| D、将等物质的量浓度、等体积的Ba(OH)2溶液和NaHS04溶液混合:Ba2++SO42?+H++OH?═BaSO4↓+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Y、Z和W三种元素可能位于同一周期 |
| B、Y和W所形成的含氧酸均为强酸 |
| C、X、Y、Z和W可以组成原子的物质的量之比为5:1:4:1的离子化合物 |
| D、上述元素形成的氢化物中,W的氢化物相对分子质量最大,熔沸点最高 |
查看答案和解析>>
科目:高中化学 来源: 题型:
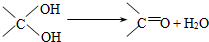

查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| △ |
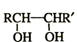
| HIO4 |
| △ |

查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com