
| A. | 剩余固体的铁、铜混合物 | |
| B. | 反应后溶液中n(Fe3+)=0.10mol | |
| C. | 原固体混合物中铜的质量是9.6g | |
| D. | 反应后溶液中n(Fe2+)+n(Cu2+)=0.64mol |
分析 铁比铜活泼,与FeCl3溶液反应时先后发生Cu+2Fe3+=Cu2++2Fe2+ Fe+2Fe3+=3Fe2+,n(FeCl3)=0.5mol,结合反应的方程式解答.
解答 解:铁的还原性强于铜,把其加入氯化铁溶液中,铁先与铁离子反应,氯化铁的物质的量是0.5mol,
Cu+2Fe3+=Cu2++2Fe2+ Fe+2Fe3+=3Fe2+
64g 2mol 56g 2mol
m1 0.5mol m2 0.5mol
m1=16g,m2=14g,
溶解的金属质量是18-3.2=14.8,则两种金属都参与反应,Fe3+完全反应,剩余的金属是铜,故A、B错;
列方程进行计算,设反应的铜的物质的量是n1,反应的铁是n2
64n1+56n2=14.8g
2n1+2n2=0.5mol
解得:n1=0.1mol,n2=0.15mol,
则原来含有的铜的质量是:0.1mol×64g/mol+3.2g=9.6g,故C正确;
溶液中的n(Fe2+)+n(Cu2+)=0.25mol+0.5mol=0.75mol,故D错误.
故选C.
点评 本题考查混合物的计算,侧重于学生的分析能力和计算能力的考查,注意根据反应的相关方程式从质量守恒的角度解答,难度中等.


科目:高中化学 来源: 题型:选择题
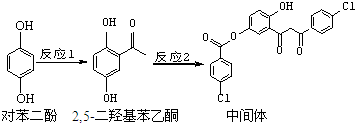
| A. | 对苯二酚在空气中能稳定存在 | |
| B. | 1 mol该中间体最多可与11 mol H2反应 | |
| C. | 2,5-二羟基苯乙酮能发生加成、水解、缩聚反应 | |
| D. | 该中间体分子中含有1个手性碳原子 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 某溶液100mL,其中含硫酸0.03mol,硝酸0.04mol,若在该溶液中投入1.92 g铜粉微热,反应后放出一氧化氮气体约为0.015mol | |
| B. | 室温时,在容积为a mL的试管中充满NO2气体,然后倒置在水中到管内水面不再上升时为止;再通入b mL O2,则管内液面又继续上升,测得试管内最后剩余气体为c mL,且该气体不能支持燃烧.则a、b的关系是a=4b+c | |
| C. | 已知某温度Ksp(Ag2S)=6×10-50,Ksp(AgCl)=2×10-6,则2AgCl(s)+S2-(aq)?Ag2S(s)+2Cl-(aq)的平衡常数约为6.7×10-37 | |
| D. | 在25℃下,将2a mol•L-1的氨水与0.02 mol•L-1的盐酸等体积混合,反应完全时溶液中c(NH4+)=c(Cl-),则用含a的代数式表示NH3•H2O的电离常数Kb=$\frac{10-9}{a-0.01}$ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 键能 | 半径 | 键的极性 | 沸点 |
| H-Cl>H-I | Cl-<Br- | H-Cl>H-Br | HF>HI |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题




查看答案和解析>>
科目:高中化学 来源: 题型:解答题
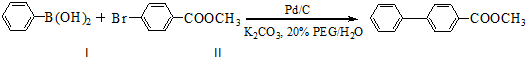

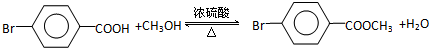 .
.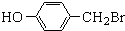 ,
,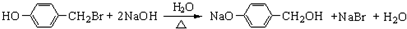
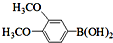 与化合物
与化合物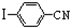 在一定条件可发生类似反应①的反应,其产物的结构简式为
在一定条件可发生类似反应①的反应,其产物的结构简式为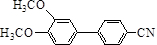 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | AgOH溶于氨水:AgOH+2NH3•H2O=[Ag(NH3)2]++OHˉ+2H2O | |
| B. | Na2C2O4水解:C2O42-+2H2O=H2C2O4+2OH- | |
| C. | 向NaAlO2溶液中通入过量的CO2:2AlO2-+CO2+3H2O=2Al(OH)3↓+CO32- | |
| D. | 向酸性KMnO4溶液中通入SO2:2MnO4-+5SO2+4OH-=2Mn2++5SO42-+2H2O |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com