
【题目】某学生对SO2与漂粉精的反应进行实验探究:
操作 | 现象 |
取4g漂粉精固体,加入100mL水 | 部分固体溶解,溶液略有颜色 |
过滤,测漂粉精溶液的pH | pH试纸先变蓝(约为12),后褪色 |
| 液面上方出现白雾; |
(1)C12和Ca(OH)2制取漂粉精的化学方程是_________。
(2)pH试纸颜色的变化说明漂粉精溶液具有的性质是_________。
(3)向水中持续通入SO2,未观察到白雾。推测现象i的白雾由HC1小液滴形成,进行如下实验:
a.用湿润的碘化钾淀粉试纸检验白雾,无变化;
b.用酸化的AgNO3溶液检验白雾,产生白色沉淀。
① 实验a目的是______。
②由实验a、b不能判断白雾中含有HC1,理由是________。
(4)现象ii中溶液变为黄绿色的可能原因:随溶液酸性的增强,漂粉精的有效成分和C1-发生反应。通过进一步实验确认了这种可能性,其实验方案是______。
(5)将A瓶中混合物过滤、洗涤,得到沉淀X
①向沉淀X中加入稀HC1,无明显变化。取上层清液,加入BaC12溶液,产生白色沉淀。则沉淀X中含有的物质是_____。
②用离子方程式解释现象iii中黄绿色褪去的原因:________。
【答案】2Cl2+2Ca(OH)2 =Ca(ClO)2+CaCl2+2H2O 漂白性 检验氯气 SO2也能和酸化的硝酸银生成白色沉淀 要证明现象II中黄绿色为溶液酸性的增强引起的,可以在原溶液中滴加稀硫酸,观察溶液的颜色变化即可 CaSO4 Cl2+SO2+2H2O===2Cl-+4H++ SO42-
【解析】
(1)漂粉精的制备,氯气和碱反应,利用氢氧化钙和氯气发生反应生成次氯酸钙、氯化钙和水;
(2)pH试纸先变蓝(约为12),后褪色说明溶液呈碱性,具有漂白性;
(3)①反应中生成Cl2,用湿润的碘化钾淀粉试纸检验白雾中是否Cl2,排除Cl2干扰;
②白雾中含有SO2,可以被硝酸氧化为硫酸,故SO2可以使酸化的AgNO3溶液产生白色沉淀;
(4)依据次氯酸根离子和氯离子在酸溶液中会发生归中反应生成氯气,向漂粉精溶液中逐滴滴入硫酸,观察溶液颜色是否变为黄绿色;
(5)二氧化硫通入漂白精溶液中,形成酸溶液,次氯酸根离子具有强氧化性可以氧化二氧化硫为硫酸和钙离子形成硫酸钙沉淀;二氧化硫继续通入后和生成的氯气发生反应生成硫酸和盐酸。
(1)氯气和碱反应,利用氢氧化钙和氯气发生反应生成次氯酸钙、氯化钙和水,反应的化学方程式为:2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O;
故答案为2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O;
(2)pH试纸先变蓝(约为12)溶液呈碱性,后褪色溶液具有漂白性,所以说明溶液呈碱性,具有漂白性;
(3)向水中持续通入SO2,未观察到白雾.推测现象的白雾由HCl小液滴形成,
①用湿润的碘化钾淀粉试纸检验白雾,无变化;为了检验白雾中是否含有氯气,因为含有氯气在检验氯化氢存在时产生干扰;故答案为检验白雾中是否含有Cl2,排除Cl2干扰;
②用酸化的AgNO3溶液检验白雾,产生白色沉淀,若含有二氧化硫气体,通入硝酸酸化的硝酸银溶液,会被硝酸氧化为硫酸,硫酸和硝酸银反应也可以生成硫酸银沉淀,所以通过实验不能证明一定含有氯化氢;故答案为白雾中混有SO2,SO2可与酸化的AgNO3反应产生白色沉淀;
(4)现象ⅱ中溶液变为黄绿色的可能原因:随溶液酸性的增强,漂粉精的有效成分和Cl-发生反应.通过进一步实验确认了这种可能性,漂粉精中成分为次氯酸钙、氯化钙,次氯酸根具有强氧化性在酸性溶液中可以氧化氯离子为 氯气;
故答案为:向漂粉精溶液中逐滴加入硫酸,观察溶液是否变为黄绿色;
(5)①取上层清液,加入BaC12溶液,产生白色沉淀,说明SO2被氧化为SO42-,故沉淀X为CaSO4;
②溶液呈黄绿色,有Cl2生成,Cl2与SO2反应生成盐酸与硫酸;反应的离子方程式为:SO2+Cl2+2H2O=SO42-+2Cl-+4H+。


 同步轻松练习系列答案
同步轻松练习系列答案 课课通课程标准思维方法与能力训练系列答案
课课通课程标准思维方法与能力训练系列答案科目:高中化学 来源: 题型:
【题目】下述实验不能达到预期实验目的的是
序号 | 实验内容 | 实验目的 |
A | 将2.5gCuSO45H2O溶解在97.5g水中 | 配制质量分数为1.6%的CuSO4溶液 |
B | 向盛有1mL硝酸银溶液的试管中滴加NaCl溶液,至不再有沉淀生成,再向其中滴加Na2S溶液 | 说明一种沉淀能转化为另一种溶解度更小的沉淀 |
C | 室温下,用pH试纸测定浓度为0.1molL-1NaClO溶液和0.1molL-1CH3COONa溶液的pH | 比较HClO和CH3COOH的酸性强弱 |
D | 室温下,分别向2支试管中加入相同体积、相同浓度的Na2S2O3溶液,再分别加入相同体积不同浓度的稀硫酸 | 研究浓度对反应速率的影响 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I. 用50 mL 0.50 mol·L-1盐酸与50 mL 0.55 mol·L-1NaOH溶液在如图所示的装置中进行中和反应。通过测定反应过程中所放出的热量可计算中和热。回答下列问题:
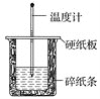
(1)从实验装置上看,图中尚缺少的一种玻璃仪器是________。
(2)如果用60 mL 0.50 mol·L-1盐酸与50 mL 0.55 mol·L-1NaOH溶液进行反应,与上述实验相比,所求中和热________(填“相等”或“不相等”)。
(3)实验时所用盐酸及NaOH溶液的体积均为50 mL,各溶液密度均为1 g·mL-1,生成溶液的比热容c=4.18 J·g-1·℃-1,实验起始温度为t1℃,终止温度为t2℃。试推断中和热的计算式ΔH=________。
(4)用相同浓度和体积的氨水代替NaOH溶液进行上述实验,测得的中和热的数值会________(填“偏大”、“偏小”或“无影响”)。
II.某研究性学习小组利用H2C2O4溶液和酸性KMnO4溶液的反应探究“外界条件的改变对化学反应速率的影响”,进行了如下实验:
实验序号 | 实验温度/K | 有关物质 | 溶液颜色褪至无色所需时间/s | ||||
酸性KMnO4溶液 | H2C2O4溶液 | H2O | |||||
V/mL | c/ mol·L-1 | VmL | c/ mol·L-1 | V/mL | |||
A | 293 | 2 | 0.02 | 4 | 0.1 | 0 | t1 |
B | T1 | 2 | 0.02 | 3 | 0.1 | V1 | 8 |
C | 313 | 2 | 0.02 | V2 | 0.1 | 1 | t2 |
(1)通过实验A、B,可探究出________(填外部因素)的改变对化学反应速率的影响,其中V1=________、T1=________;通过实验________(填实验序号)可探究出温度变化对化学反应速率的影响,其中V2=________。
(2)若t1<8,则由此实验可以得出的结论是________________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验过程中,产生现象与对应的图形相符合的是( )
A.NaHSO3粉末加入HNO3溶液中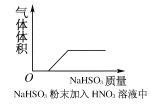
B.H2S气体通入氯水中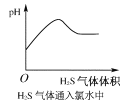
C.NaOH溶液滴入Ba(HCO3)2溶液中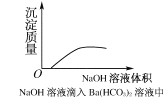
D.CO2气体通入澄清石灰水中
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“变化观念与平衡思想”是化学学科的核心素养,室温时0.10mol/L草酸钠溶液中存在多个平衡,其中有关说法正确的是(已知室温时,Ksp(CaC2O4)=2.4×10-9)( )
A.若将溶液不断加水稀释,则水的电离程度增大
B.溶液中各离子浓度大小关系c(Na+)>c(C2O42-)>c(OH-)>c(H+)>c(HC2O4-)
C.若用pH计测得溶液的pH=a,则H2C2O4的第二级电离平衡常数Ka2=1013-2a
D.向溶液中加入等体积CaCl2溶液,当加入的CaCl2溶液浓度大于2.4×10-8mol/L时即能产生沉淀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、Q、R是五种短周期元素,原子序数依次增大。X、Y两元素最高正价与最低负价之和均为0;Q与X同主族;Z、R分别是地壳中含量最高的非金属元素和金属元素。
请回答下列问题:
(1)写出R的原子结构示意图:________________
(2)五种元素原子半径由大到小的顺序是(写元素符号) .
(3)X与Y能形成多种化合物其中既含极性键又含非极性键,且相对分子质量最小的物质是(写分子式) ,X和Z组成的化合物的化学式为___________________
(4)由以上某些元素组成的化合物A、B、C、D有如下转化关系:A![]() B(在水溶液中进行),其中,C是溶于水显酸性的气体;D是淡黄色固体。写出C的化学式 ;D的电子式 .
B(在水溶液中进行),其中,C是溶于水显酸性的气体;D是淡黄色固体。写出C的化学式 ;D的电子式 .
①如果A、B均由三种元素组成,B为两性不溶物,则A![]() B离子反应方程式为_________
B离子反应方程式为_________
②A、B均为盐溶液,如果A由三种元素组成,B由四种元素组成,A、B溶液均显碱性.用离子方程式表示A溶液显碱性的原因 ;常温下,在该溶液中滴加稀盐酸至中性时,溶质的主要成分有 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,H2A是一种易溶于水的二元酸,将NaOH溶液滴入等物质的量浓度的H2A溶液中,溶液中H2A、HA-、A2-的物质的量分数随溶液pH的变化关系如图所示。下列说法错误的是( )

A. 常温下,H2A的电离平衡常数 Ka1=10-3.30
B. 当 c(Na+)=2c(A2-)+c(HA-)时,溶液呈中性
C. pH=6.27时,c(A2-)=c(HA-)>c(H+)>c(OH-)
D. V(NaOH溶液):V(H2A溶液)=3∶2 时,2c(Na+)+c(OH-)=2c(H2A)+c(HA-)+c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知几种盐溶液的pH如表所示:
① | ② | ③ | |
均为0.1 mol·L-1溶液 | NaHCO3 | Na2CO3 | NaClO |
常温下溶液pH | 9.7 | 11.6 | 10.3 |
下列说法正确的是
A.三种溶液中水的电离程度:①>③>②
B.每种溶液都只存在1种微粒的电离平衡
C.①与②中均存在:c(CO32-)+c(HCO3-)+c(OH-)=c(Na+)+c(H+)
D.向NaClO溶液中通入少量CO2的反应为ClO-+CO2+H2O=HClO+HCO3-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用含锂废渣(主要金属元素的含量:Li 3.50% Ni 6.55% Ca 6.41% Mg 13.24%)制备Li2CO3,并用其制备Li+电池的正极材料LiFePO4。部分工艺流程如下:
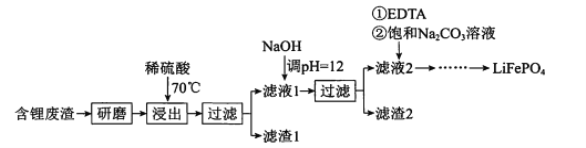
资料:ⅰ滤液1、滤液2中部分两者的浓度(g/L)

ⅱEDTA能和某些二价金属离子形成稳定的水溶性络合物。
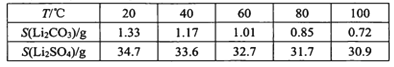
ⅲ某些物质溶解度(S):
I.制备Li2CO3粗品
(l)上述流程中为加快化学反应速率而采取的措施是 ___。
(2)向滤液2中先加入EDTA,再加入饱和Na2CO3溶液,90℃充分反应后,分离出 固体Li2CO3粗品的操作是 ______。
(3)处理lkg含锂3.50%的废渣,锂的浸出率为a,Li+转化为Li2CO3的转化率为b,则粗品中含Li2CO3的质量是 ____g。(摩尔质量:Li 7 g.mol-l Li2CO3 74 g.mol-l)
II.纯化Li2CO3粗品
(4)将Li2CO3转化为LiHCO3后,用隔膜法电解LiHCO3溶液制备高纯度的LiOH,再转化得电池级Li2CO3。电解原理如图所示,阳极的电极反应式是 _______。
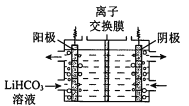
III.制备LiFePO4
(5)将电池级Li2CO3和C、FePO4高温下反应,生成LiFePO4和一种可燃性气体,该反应的化学方程式是__。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com