
【题目】下述实验不能达到预期实验目的的是
序号 | 实验内容 | 实验目的 |
A | 将2.5gCuSO45H2O溶解在97.5g水中 | 配制质量分数为1.6%的CuSO4溶液 |
B | 向盛有1mL硝酸银溶液的试管中滴加NaCl溶液,至不再有沉淀生成,再向其中滴加Na2S溶液 | 说明一种沉淀能转化为另一种溶解度更小的沉淀 |
C | 室温下,用pH试纸测定浓度为0.1molL-1NaClO溶液和0.1molL-1CH3COONa溶液的pH | 比较HClO和CH3COOH的酸性强弱 |
D | 室温下,分别向2支试管中加入相同体积、相同浓度的Na2S2O3溶液,再分别加入相同体积不同浓度的稀硫酸 | 研究浓度对反应速率的影响 |
A.AB.BC.CD.D
【答案】C
【解析】
A.2.5gCuSO45H2O中CuSO4的质量为2.5g×![]() =1.6g,溶液的质量为2.5g+97.5g=100g,则能配制质量分数为1.6%的CuSO4溶液,故不选A;
=1.6g,溶液的质量为2.5g+97.5g=100g,则能配制质量分数为1.6%的CuSO4溶液,故不选A;
B.因硫化银比氯化银更难溶,则向盛有1mL硝酸银溶液的试管中滴加NaCl溶液,至不再有沉淀生成,再向其中滴加Na2S溶液,会得到黑色沉淀,说明一种沉淀能转化为另一种解度更小的沉淀,故不选B;
C.pH试纸不能测出NaClO溶液的pH,能使试纸褪色,则不能用pH试纸测定浓度为0.1molL-1NaClO溶液和0.1molL-1CH3COONa溶液的pH来比较HClO和CH3COOH的酸性强弱,故选C;
D.固定其他因素不变,则稀硫酸的浓度不同,反应的反应速率不同,故D正确;
答案选C


科目:高中化学 来源: 题型:
【题目】Mn和Bi形成的晶体薄膜是一种金属间化合物![]() 晶胞结构如图
晶胞结构如图![]() ,有关说法正确的( )
,有关说法正确的( )
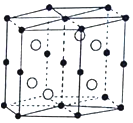
A.锰价电子排布为![]()
B.Bi是d区金属
C.该合金堆积方式是简单立方
D.该晶体的化学式为MnBi
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有A、B、C、D、E五种元素,其相关信息如表:
元素 | 相关信息 |
A | A原子的1s轨道上只有1个电子 |
B | B是电负性最大的元素 |
C | C基态原子的2p轨道中有3个未成对电子 |
D | D是主族元素且与E同周期,其最外能层上有2个运动状态不同的电子 |
E | E能形成红色(或砖红色)的E2O和黑色的EO两种氧化物 |
请回答下列问题:
(1)写出E元素原子基态时的电子排布式_______________。
(2)C元素的第一电离能比氧元素的第一电离能_______________ (填“大”或“小”) 。
(3)CA3分子中C原子的杂化类型是_______________。
(4)A、C、E三种元素可形成[E(CA3)4]2+,其中存在的化学键类型有____(填序号);
①配位键 ②金属键 ③极性共价键 ④非极性共价键 ⑤离子键 ⑥氢键
若[E(CA3)4]2+具有对称的空间构型,且当[E(CA3)4]2+中的两个CA3被两个Cl取代时,能得到两种不同结构的产物,则[E(CA3)4]2+的空间构型为____________ (填序号)。
a.平面正方形 b.正四面体 c.三角锥形 d.V形
(5)B与D可形成离子化合物,其晶胞结构如图所示,其中D离子的配位数为_______________,若该晶体的密度为a g·cm3,则该晶胞的体积是_____________cm3(写出表达式即可)。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关说法不正确的是( )
A. 水合铜离子的模型如图所示,1个水合铜离子中有4个配位键
水合铜离子的模型如图所示,1个水合铜离子中有4个配位键
B. CaF2晶体的晶胞如图所示,每个CaF2晶胞平均占有4个Ca2+
CaF2晶体的晶胞如图所示,每个CaF2晶胞平均占有4个Ca2+
C. H原子的电子云图如图所示,H原子核外的大多数电子在原子核附近运动
H原子的电子云图如图所示,H原子核外的大多数电子在原子核附近运动
D. 金属Ag的原子堆积模型如图所示,该金属晶体为最密堆积,每个Ag原子的配位数均为12
金属Ag的原子堆积模型如图所示,该金属晶体为最密堆积,每个Ag原子的配位数均为12
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】元素X的+1价离子X+中所有电子正好充满K、L、M三个电子层,它与N3-形成的晶体结构如图所示。下列说法错误的是

A. X元素的原子序数是19 B. 该晶体中阳离子与阴离子个数比为3 : 1
C. X+离子是图中的黑球 D. X+的半径大于N3-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定条件下,在密闭容器中,发生可逆反应2NO2(g) ![]() 2NO(g) +O2(g),达到平衡状态的标志是:
2NO(g) +O2(g),达到平衡状态的标志是:
A.单位时间生成n mol O2,同时生成2n mol NO
B.用NO2、NO、O2表示反应速率之比为2:2:1的状态
C.NO2、NO、O2的物质的量之比为2:2:1的状态
D.混合气体的颜色不再改变的状态
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关说法正确的是( )

A. 水合铜离子的模型如图1所示,1个水合铜离子中有4个配位键
B. CaF2晶体的晶胞如图2所示,每个CaF2晶胞平均占有4个Ca2+,4个F﹣
C. H原子的电子云图如图3所示,H原子核外大多数电子在原子核附近运动
D. 原子堆积模型如图4,可表示Mg原子的堆积方式
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下的定容容器中,当下列哪些物理量不再发生变化时,表明反应:
A(s)+2B(g)![]() C(g)+D(g)已达到平衡状态的是( )
C(g)+D(g)已达到平衡状态的是( )
① 混合气体的压强;② 混合气体的密度;③ B的物质的量浓度;④ 气体总物质的量;⑤ 混合气体的平均相对分子质量;⑥ C、D反应速率的比值
A. ②③⑤ B. ①②③ C. ②③④⑥ D. ①③④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学生对SO2与漂粉精的反应进行实验探究:
操作 | 现象 |
取4g漂粉精固体,加入100mL水 | 部分固体溶解,溶液略有颜色 |
过滤,测漂粉精溶液的pH | pH试纸先变蓝(约为12),后褪色 |
| 液面上方出现白雾; |
(1)C12和Ca(OH)2制取漂粉精的化学方程是_________。
(2)pH试纸颜色的变化说明漂粉精溶液具有的性质是_________。
(3)向水中持续通入SO2,未观察到白雾。推测现象i的白雾由HC1小液滴形成,进行如下实验:
a.用湿润的碘化钾淀粉试纸检验白雾,无变化;
b.用酸化的AgNO3溶液检验白雾,产生白色沉淀。
① 实验a目的是______。
②由实验a、b不能判断白雾中含有HC1,理由是________。
(4)现象ii中溶液变为黄绿色的可能原因:随溶液酸性的增强,漂粉精的有效成分和C1-发生反应。通过进一步实验确认了这种可能性,其实验方案是______。
(5)将A瓶中混合物过滤、洗涤,得到沉淀X
①向沉淀X中加入稀HC1,无明显变化。取上层清液,加入BaC12溶液,产生白色沉淀。则沉淀X中含有的物质是_____。
②用离子方程式解释现象iii中黄绿色褪去的原因:________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com