
【题目】已知:①从石油中获得是目前工业上生产A的主要途径,A的产量通常用来衡量一个国家的石油化工发展水平;②2CH3CHO+O2![]() 2CH3COOH。
2CH3COOH。
现以A为主要原料合成乙酸乙酯,其合成路线如图所示:

回答下列问题:
(1)写出A的结构简式:___。
(2)B、D分子中的官能团名称分别是___、___。
(3)写出下列反应的反应类型:①___,②___,④___。
(4)写出下列反应的化学方程式:
①___。
②___。
④___。
【答案】CH2=CH2 羟基 羧基 加成反应 氧化反应 酯化反应(或取代反应) CH2=CH2+H2O![]() CH3CH2OH 2CH3CH2OH+O2
CH3CH2OH 2CH3CH2OH+O2![]() 2CH3CHO+2H2O CH3COOH+CH3CH2OH
2CH3CHO+2H2O CH3COOH+CH3CH2OH![]() CH3COOCH2CH3+H2O
CH3COOCH2CH3+H2O
【解析】
根据该流程图B与D反应生成乙酸乙酯酯,可得B是乙醇,C是乙醛,D是乙酸;A是从石油中获得,且A的产量通常用来衡量一个国家的石油化工发展水平,则A是乙烯。
(1)A是乙烯,结构简式为CH2=CH2;
(2)B是乙醇,D是乙酸,分子中的官能团名称分别是羟基、羧基;
(3)反应①是乙烯和水加成生成乙醇;反应②是乙醇氧化生成乙醛;反应④是酸和醇发生酯化反应生成酯,属于取代反应;
(4)反应①是乙烯和水加成生成乙醇:CH2=CH2+H2O![]() CH3CH2OH;反应②是乙醇氧化生成乙醛:2CH3CH2OH+O2
CH3CH2OH;反应②是乙醇氧化生成乙醛:2CH3CH2OH+O2![]() 2CH3CHO+2H2O;反应④是乙酸和乙醇发生酯化反应生成乙酸乙酯:CH3COOH+CH3CH2OH
2CH3CHO+2H2O;反应④是乙酸和乙醇发生酯化反应生成乙酸乙酯:CH3COOH+CH3CH2OH![]() CH3COOCH2CH3+H2O。
CH3COOCH2CH3+H2O。


科目:高中化学 来源: 题型:
【题目】碘在地壳中主要以NaIO3的形式存在,在海水中主要以I-的形式存在,几种微粒之间的转化关系如图所示。已知:淀粉遇单质碘变蓝。下列说法中,不正确的是
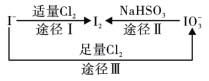
A. 氧化性的强弱顺序为:Cl2 >IO3- >I2
B. 一定条件下, I-与IO3-反应可能生成I2
C. 途径Ⅱ中若生成1mol I2,消耗4mol NaHSO3
D. 向含I-的溶液中通入Cl2,所得溶液加入淀粉溶液不一定变为蓝色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是部分短周期元素化合价与原子序数的关系图,下列说法正确的是( )

A.原子半径:Z>Y>X
B.Y和Z两者最高价氧化物对应的水化物能相互反应
C.气态氢化物的稳定性:R<W
D.WX3和水反应形成的化合物是离子化合物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】原儿茶醛是一种医药中间体,一种合成路线如图:

已知:①D能与FeCl3溶液发生显色反应,E与FeCl3溶液不发生显色反应;
②G能发生银镜反应;
③苯酚在多聚甲醛和氯化氢作用下,在邻位或对位发生取代反应。
回答下列问题:
(1)A中的官能团名称是____。
(2)碳原子上连有4个不同的原子或基团时,该碳称为手性碳。在B的结构简式中用星号(*)标出B中的手性碳:____。
(3)反应①的类型是_____;反应②所需的试剂和条件是_____。
(4)写出D到E反应的化学方程式:______。
(5)G的结构简式是____。
(6)W与C互为同分异构体,W中不含环状结构,能发生水解反应,核磁共振氢谱只有3组峰且峰面积之比为6:3:1,W的结构简式为_____(只写一种)。
(7)设计以苯酚和(CH2O)n为原料制备 的合成路线。(无机试剂任选)____
的合成路线。(无机试剂任选)____
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)普通锌锰干电池的结构如图所示。回答下列问题。

①电池中电解质溶液为___。
②负极反应式为___,放电时正极(碳棒)上发生反应的物质是___。
③放电时,NH4+向___ (填“正极”或“负极”)移动。
(2)废电池中的锌皮常用于实验室制氢气,废锌皮和纯锌粒分别与同浓度的稀硫酸反应,产生氢气速率较大的是___,原因是___。
若用过量的纯锌粒与一定量的稀硫酸反应,为了加快反应速率又不影响产生氢气的量,下列措施可行的是___(填字母)。
A.微热
B.加入适量氧化铜
C.加入少量硫酸铜溶液
D.加水
E.加入少量氢氧化钡溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知分解1mol KClO3放出热量38.8kJ,在存在MnO2条件下加热,KClO3的分解机理为:
①2KClO3+4MnO2=2KCl+2Mn2O7 慢 ②2Mn2O7=4MnO2+3O2 快
下列有关说法中不正确的是( )
A. 1mol KClO3所具有的总能量高于1mol KCl和1.5mol O2所具有的总能量
B. KClO3分解速率快慢主要取决于反应①
C. 1g KClO3、1g MnO2和0.1g Mn2O7混合加热,充分反应后MnO2质量为1g
D. 将固体二氧化锰碾碎,可加快KClO3的分解速率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】分别按如图甲、乙所示装置进行实验,图中两个烧杯里的溶液为同浓度的稀硫酸,乙中A为电流表,以下叙述中,不正确的是( )

A.两烧杯中铜片表面均有气泡产生
B.两烧杯中溶液pH均增大
C.产生气泡的速度甲中比乙中慢
D.乙实验中,把硫酸换成硫酸铁溶液,铜电极的电极反应式为Fe3++e-=Fe2+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】重铬酸钾(K2Cr2O7)是一种强氧化剂,可用于检测酒驾中酒精的含量,电化学制备K2Cr2O7的装置如图所示,其中a、b均为石墨电极。下列说法正确的是

A. X是电源的正极
B. 电解过程中K+向b极移动
C. b极上发生的电极反应为:2CrO42-+2H+=Cr2O72-+H2O
D. 理论上a、b两电极放出的气体的物质的量之比为2︰1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究小组为探究SO2和Fe(NO3)3溶液的反应的实质。设计了如下图所示装置进行实验.
已知:1.0 mol/L的Fe(NO3)3溶液的pH=1。

请回答:
(1)装置A中用于添加浓硫酸的仪器名称为__________________。
(2)实验前鼓入N2的目的是________________________________。
(3)装置B中产生了白色沉淀,其成分是________,说明SO2具有________性。
(4)分析B中产生白色沉淀的原因。
观点1:SO2与Fe3+反应;
观点2:在酸性条件下SO2与NO3-反应;
①若观点1正确,除产生沉淀外,还应观察到的现象是_________________。
②按观点2,装置B中反应的离子方程式是______________________________,
③有人认为,如将装置B中的Fe(NO3)3溶液替换为等体积的下列溶液,在相同条件下进行实验,也可验证观点2是否正确。此时应选择的最佳试剂是(填序号)_____。
A.1 mol/L稀硝酸 |
B.1.5 mol/L Fe(NO3)2溶液 |
C.6.0 mol/L NaNO3溶液和0.2 mol/L盐酸等体积混合的溶液 |
D.3.0 mol/L NaNO3溶液和0.1mol/L硫酸等体积混合的溶液 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com