
【题目】为了测定实验室长期存放的Na2SO3固体的纯度,准确称取W g固体样品,配成250 mL溶液。设计了以下两种实验方案:
方案I:取25.00 mL上述溶液→加入足量的盐酸酸化的BaCl2溶液→操作I→洗涤→操作Ⅱ→称量,得到沉淀的质量为m1 g
方案Ⅱ:取25.00 mL上述溶液,用a mol/L 的酸性KMnO4溶液进行滴定。(5SO32-+2MnO4-+6H+→5SO42-+2Mn2++3H2O)
实验中所记录的数据如下表:
滴定次数 实验数据 | 1 | 2 | 3 | 4 |
待测溶液体积/mL | 25.00 | 25.00 | 25.00 | 25.00 |
滴定管初读数/mL | 0.00 | 0.20 | 0.10 | 0.15 |
滴定管末读数/mL | 20.95 | 21.20 | 20.15 | 21.20 |
(1)配制250 mL Na2SO3溶液时,必须用到的实验仪器有:烧杯、玻棒、滴管、药匙和__________________、_________________。
(2)操作I为____________________操作Ⅱ为________________
(3)方案I中如何判别加入的氯化钡已经过量_____________在方案Ⅱ中滴定终点的判断方法是________________。
(4)根据方案Ⅱ所提供的数据,计算Na2SO3的纯度为______________。(写成分数形式)有同学模仿方案I,提出方案Ⅲ:取25.00 mL上述溶液→加入足量的盐酸酸化的Ba(NO3)2溶液→操作I→洗涤→操作Ⅱ→称重,得到沉淀质量为m2 g 并用方案I的方法计算结果。
(5)根据方案Ⅲ,从理论上讲,下列说法正确的是________(填序号)
a. 方案I比方案Ⅲ的计算结果要低
b. 方案I比方案Ⅲ的计算结果要高
c. m1=m2 ,方案I和方案Ⅲ的结果一样
d. 方案Ⅲ不应根据方案I的方法计算
(6)上述实验中,由于操作错误所引起的实验误差分析正确的是__________(填序号)。
a. 方案I中如果没有洗涤操作,实验结果将偏小
b. 方案I中如果没有操作Ⅱ,实验结果将偏大
c. 方案Ⅲ中如果没有洗涤操作,实验结果将偏小
d. 方案Ⅲ中如果没有操作Ⅱ,实验结果将偏大
【答案】 电子天平 250mL的容量瓶 过滤 干燥(烘干) 静置分层后,向上清液中加入盐酸酸化的氯化钡,不再产生沉淀,即已沉淀完全 加入最后一滴后溶液由无色变为紫色,且在半分钟内不褪 1323a÷20W×100% bd ad
【解析】(1)配制250 mL Na2SO3溶液时,必须用到的实验仪器有:烧杯、玻棒、滴管、药匙和电子天平、250mL的容量瓶。(2)加入氯化钡产生白色沉淀,因此操作I为过滤;沉淀洗涤后称量前需要干燥,即操作Ⅱ为干燥(烘干);(3)根据硫酸钡是不溶于水也不溶于酸的白色沉淀判断方案I中加入的氯化钡已经过量,即;静置分层后,向上清液中加入盐酸酸化的氯化钡,不再产生沉淀,即已沉淀完全;酸性高锰酸钾溶液显紫红色,则在方案Ⅱ中滴定终点的判断方法是加入最后一滴后溶液由无色变为紫色,且在半分钟内不褪。(4)四次实验消耗标准液体积分别是(mL)20.95、21.00、20.05、21.05,显然第三次数据误差较大,舍去,则其平均值是21.00mL,根据方程式可知25mL溶液中亚硫酸钠的物质的量是2.5×0.021L×amol/L=0.0525amol,实验亚硫酸钠的纯度是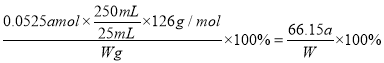 。(5)a.酸性溶液中硝酸根具有强氧化性,能把亚硫酸钠氧化为硫酸钠,因此方案I比方案Ⅲ的计算结果要高,a错误;b.方案I比方案Ⅲ的计算结果要高,b正确;c.方案Ⅲ中S元素全部转化为硫酸钡,因此方案I和方案Ⅲ的结果不可能一样,c错误;d.方案Ⅲ中S元素全部转化为硫酸钡,因此方案Ⅲ不应根据方案I的方法计算,d正确,答案选bd;(6)a.方案I中如果没有洗涤操作,则硫酸钡质量增加,所以实验结果将偏小,a正确;b.方案I中如果没有操作Ⅱ,即没有干燥,则硫酸钡质量增加,所以实验结果将偏小,b错误;c.方案Ⅲ中如果没有洗涤操作,硫酸钡质量增加,实验结果将偏大,c错误;d.方案Ⅲ中如果没有操作Ⅱ,硫酸钡质量增加,实验结果将偏大,d正确,答案选ad。
。(5)a.酸性溶液中硝酸根具有强氧化性,能把亚硫酸钠氧化为硫酸钠,因此方案I比方案Ⅲ的计算结果要高,a错误;b.方案I比方案Ⅲ的计算结果要高,b正确;c.方案Ⅲ中S元素全部转化为硫酸钡,因此方案I和方案Ⅲ的结果不可能一样,c错误;d.方案Ⅲ中S元素全部转化为硫酸钡,因此方案Ⅲ不应根据方案I的方法计算,d正确,答案选bd;(6)a.方案I中如果没有洗涤操作,则硫酸钡质量增加,所以实验结果将偏小,a正确;b.方案I中如果没有操作Ⅱ,即没有干燥,则硫酸钡质量增加,所以实验结果将偏小,b错误;c.方案Ⅲ中如果没有洗涤操作,硫酸钡质量增加,实验结果将偏大,c错误;d.方案Ⅲ中如果没有操作Ⅱ,硫酸钡质量增加,实验结果将偏大,d正确,答案选ad。


 优等生题库系列答案
优等生题库系列答案科目:高中化学 来源: 题型:
【题目】实验室保存下列化学试剂的方法不正确的是( )
A.新制氯水放在棕色试剂瓶中,避光保存
B.液溴密封盛放在棕色瓶中,液面上放一层水
C.少量金属钠保存在四氯化碳中
D.水玻璃保存在带胶塞的玻璃试剂瓶中
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】K2SO4是制备K2CO3、KAl(SO4)2等钾盐的原料,可用于玻璃、染料、香料等工业,在医药上可用作缓泻剂,在农业上是主要的无氯钾肥。以下是用氨碱法从明矾石提取硫酸钾工艺流程图。明矾石主要成分为K2SO4Al2(SO4)34Al(OH)3 ,通常含有少量SiO2、Fe2O3等。

回答题:
(1)用28%氨水(密度为0.898g/L)配制4%氨水(密度为0.981g/L)500mL,需28%氨水______mL,配制溶液时,应选用的仪器是______(选填序号)。
(a)20mL量筒 (b)100 mL量筒 (c)500 mL量筒 (d) 500 mL容量瓶
(2)填写下列操作名称:操作Ⅰ_________、操作Ⅱ_________、操作Ⅲ_________。
(3)硅渣主要成分是___________,(写化学式),脱硅后的固体为红泥,可用于_________。
(4)上述流程中可以循环使用的物质X是__________________。
(5)钾氮肥的主要成分是__________,请设计实验检验钾氮肥中(除K+以外)的阳离子:(写出所需试剂、实验步骤和结论)_________________;
(6)为了测定钾氮肥中钾的含量,在试样完全溶于水后,加入足量氯化钡溶液,得到白色沉淀a克,若要计算K2SO4的物质的量,还需要_____________数据,列出计算式:_____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应4A(s)+3B(g) ![]() 2C(g)+D(g),经2 min后,B的浓度减少了0.6 mol·L-1。对此反应速率的正确表示是( )
2C(g)+D(g),经2 min后,B的浓度减少了0.6 mol·L-1。对此反应速率的正确表示是( )
A. 用A表示的反应速率是0.8 mol·L-1·s-1
B. 在2 min末时的反应速率,用反应物B来表示是0.3 mol·L-1·min-1
C. 分别用B、C、D表示反应的速率,其比值是3∶2∶1
D. 在这2 min内用B和C表示的反应速率的值都是相同的
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、 C、D是原子序数依次增大的五种短周期主族元素。B、C、E最外层电子数之和为11;A 原子核外最外层电子数是次外层的2倍;C是同周期中原子半径最大的元素;工业上一般通过电解氧化物的方法制备D的单质;E单质是制备太阳能电池的重要材料。下列说法正确的是( )
A. 简单离子半径:B>C
B. 最高价氧化物对应水化物的酸性: A<E
C. 工业上不用电解氯化物的方法制备单质D是由于其氯化物的熔点高
D. 相同质量的C和D单质分别与足量稀盐酸反应,前者生成的氢气多
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学生用已知物质的量浓度的盐酸来测定未知物质的量浓度的NaOH溶液时,选用甲基橙作指示剂。请填写下列空白:
(1)用标准的盐酸滴定待测的NaOH溶液时,左手握酸式滴定管的活塞,右手摇动锥形瓶,判断滴定终点的现象是__________________。
(2)下列操作中可能使所测NaOH溶液的浓度偏低的是______。
A.酸式滴定管未用标准盐酸润洗就直接注入标准盐酸
B.滴定前盛放NaOH溶液的锥形瓶用蒸馏水洗净后没有干燥
C.酸式滴定管在滴定前有气泡,滴定后气泡消失
D.读取盐酸体积时,开始仰视读数,滴定结束时俯视读数
(3)若滴定开始和结束时,酸式滴定管中的液面如图所示,所用盐酸溶液的体积为________mL。
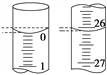
(4)某学生根据3次实验分别记录有关数据如下表:
滴定次数 | 待测NaOH溶液的体积/mL | 0.100 0 mol·L-1盐酸的体积/mL | ||
滴定前刻度 | 滴定后刻度 | 溶液体积/mL | ||
第一次 | 25.00 | 0.00 | 26.31 | 26.31 |
第二次 | 25.00 | 1.56 | a | 28.74 |
第三次 | 25.00 | 0.22 | 26.51 | b |
表格中a的数值为_________, b的数值为_________。
依据上表数据列式计算该NaOH溶液的物质的量浓度为________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质中既能跟稀H2SO4反应,又能跟氢氧化钠溶液反应的是( ) ①NaHCO3②Al2O3③Al(OH)3④Al.
A.③④
B.②③④
C.①③④
D.全部
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学生为了探究锌与盐酸反应过程中的速率变化,他在100mL稀盐酸中加入足量的锌粉,用排水集气法收集反应放出的氢气,实验记录如下(累计值):
时间(min) | 1 | 2 | 3 | 4 | 5 |
氢气体积(mL)(标况下) | 50 | 120 | 232 | 290 | 310 |
⑴ 哪一时间段(指①0~1、②1~2、③2~3、④3~4、⑤4~5 min,下同)反应速率最大______ (填序号,下同),原因是_____________________________ 。
⑵ 哪一段时段的反应速率最小______,原因是________________________。
⑶ 求2~3分钟时间段以盐酸的浓度变化来表示的该反应速率(设溶液体积不变,不要求写出计算过程)_________________ 。
⑷ 如果反应太激烈,为了减缓反应速率而又不减少产生氢气的量,他在盐酸中分别加入等体积的下列溶液: A..蒸馏水 B.KNO3溶液 C. NaCl溶液 D.CuSO4溶液
你认为可行的是(填编号) _______________________ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列表述正确的是( )
A.玛瑙的主要成分是硅酸盐
B.某浓度的HNO3在反应中不可能被还原成NH3
C.普通水泥是硅酸盐材料
D.二氧化硅是将太阳能转换为电能的常用材料
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com