
【题目】用VSEPR模型预测下列分子或离子的立体结构,其中正确的是()
A.H2O与BeCl2为V形B.CS2与SO2为直线形
C.BF3与PCl3为三角锥形D.SO3与CO32-为平面三角形
【答案】D
【解析】
A.水分子中价层电子对个数=2+![]() ×(6-2×1)=4,VSEPR模型为正四面体结构,含有2个孤电子对,略去孤电子对后,实际上其空间构型是V型;BeCl2 中Be原子的价层电子对个数=2+
×(6-2×1)=4,VSEPR模型为正四面体结构,含有2个孤电子对,略去孤电子对后,实际上其空间构型是V型;BeCl2 中Be原子的价层电子对个数=2+![]() ×(2-2×1)=2,不含孤电子对,则分子空间构型是直线型,故A错误;
×(2-2×1)=2,不含孤电子对,则分子空间构型是直线型,故A错误;
B.CS2分子中每个S原子和C原子形成两个共用电子对,所以C原子价层电子对个数是2且不含孤电子对,所以为直线形结构;SO2分子中S的价层电子对个数=2+![]() ×(6-2×2)=3,且含有1个孤电子对,所以为V形结构,故B错误;
×(6-2×2)=3,且含有1个孤电子对,所以为V形结构,故B错误;
C.BF3分子中B原子的价层电子对个数=3+![]() ×(3-3×1)=3,且不含有孤电子对,所以其空间构型为平面三角形;PCl3中P的价层电子对数=3+
×(3-3×1)=3,且不含有孤电子对,所以其空间构型为平面三角形;PCl3中P的价层电子对数=3+![]() (5-3×1)=4,含孤电子对数为1,杂化轨道数4,中心原子以采取sp3杂化,分子形状为三角锥形,故C错误;
(5-3×1)=4,含孤电子对数为1,杂化轨道数4,中心原子以采取sp3杂化,分子形状为三角锥形,故C错误;
D.SO3中S的价层电子对个数= 3+![]() (6-3×2)=3,不含孤电子对,杂化轨道数为3,硫原子采用sp2杂化,分子形状为平面三角形;CO32-中碳原子价层电子对个数=3+
(6-3×2)=3,不含孤电子对,杂化轨道数为3,硫原子采用sp2杂化,分子形状为平面三角形;CO32-中碳原子价层电子对个数=3+![]() ×(43×2+2)=3,采用sp2杂化,所以CO32-的离子立体结构为平面三角形,故D正确;
×(43×2+2)=3,采用sp2杂化,所以CO32-的离子立体结构为平面三角形,故D正确;
故选D。


科目:高中化学 来源: 题型:
【题目】铋(Bi)的化合物在电子、医药等领域应用广泛。由辉铋矿(主要成分为Bi2S3, 含杂质SiO2等,Bi2S3不溶于水和硫酸)制备Bi2O3的工艺如下。
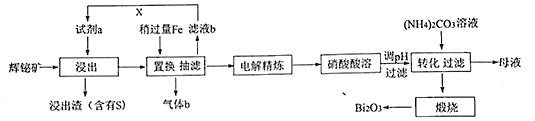
回答下列问题:
(1)试剂a最好选用的试剂是______________(填选项字母);
A. HCl溶液 B.浓H2SO4 C. H2O2溶液 D. FeCl3和HCl混合液
(2)辉铋矿的浸出液中铋元素主要以Bi3+形式存在,写出浸出过程生成S渣的离子方程式_______,“滤液b”中通入气体X后可循环利用,气体X是_______________ (写化学式);
(3)“抽滤”用如下装置完成,请选择字母代号补全正确的操作顺序(洗涤操作只做一次):

开抽气泵→a→b→d→ ____→c→ 关抽气泵;
a.转移固液混合物 b.关活塞A c.开活塞A d.确认抽干 e.加洗涤剂洗涤
(4)写出“煅烧”碱式碳酸铋[(BiO)2CO3]制备Bi2O3 的化学方程式____________________________;
(5)硝酸酸溶后调pH可得到碱式硝酸铋,碱式硝酸铋直接灼烧也能得到Bi2O3,上述工艺中却转化为碱式碳酸铋再灼烧,除了能改良产品性状,另一优点是__________________________________________;
(6)从“母液”中回收可用做炸药的物质是_________ ( 写物质名称)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】食盐是日常生活的必需品,也是重要的化工原料。
(1)粗食盐中常含有少量K+、Ca2+、Mg2+、Fe3+、SO42-等杂质离子,实验室提纯NaCl的流程如下:

提供的试剂:饱和Na2CO3溶液 饱和K2CO3溶液 NaOH溶液 BaCl2溶液 Ba(NO3)2溶液 75%乙醇 四氯化碳
①欲除去溶液Ⅰ中的Ca2+、Mg2+、Fe3+、SO42-,选出a所代表的试剂,按滴加顺序依次为________(只填化学式)。
②分离操作①中所用到的玻璃仪器有____________。
③洗涤除去NaCl晶体表面附带的少量KCl,选用的试剂为________。
(2)用提纯的NaCl配制450 mL 4.00 mol·L-1NaCl溶液,所用仪器除药匙、烧杯、玻璃棒外还有________(填仪器名称)。
(3)在实验中多次用到玻璃棒,其作用有三个,分别是______________、______________、______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】阿伏加德罗常数的值为![]() 。下列说法正确的是
。下列说法正确的是
A. 1L0.1mol·![]() NH4Cl溶液中,
NH4Cl溶液中, ![]() 的数量为0.1
的数量为0.1![]()
B. 2.4gMg与H2SO4完全反应,转移的电子数为0.1![]()
C. 标准状况下,2.24LN2和O2的混合气体中分子数为0.2![]()
D. 0.1mol H2和0.1mol I2于密闭容器中充分反应后,其分子总数为0.2![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙二酸二乙酯(D)可由石油气裂解得到的烯烃合成。回答下列问题:

(1)B和A为同系物,B的结构简式为_______。
(2)反应①的化学方程式为___________,其反应类型为__________。
(3)反应③的反应类型为____________。
(4)C的结构简式为___________。
(5)反应②的化学方程式为______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】数依次增大的四种元素A、B、C、D分别处于第一至第四周期,自然界中存在多种A的化合物,B原子核外电子有6种不同的运动状态,B与C可形成正四面体形分子,D的基态原子的最外能层只有一个电子,其他能层均已充满电子。请回答下列问题:
(1)这四种元素中电负性最大的元素,其基态原子的价电子排布图为___________________,第一电离能最小的元素是__________(填元素符号)。
(2)C所在主族的前四种元素分别与A形成的化合物,沸点由高到低的顺序是___________(填化学式)。
(3)B元素可形成多种单质,一种晶体结构如图一所示,其原子的杂化类型为__________;另一种的晶胞如图二所示,该晶胞的空间利用率为__________。(![]() =1.732)
=1.732)

(4)D元素形成的单质,其晶体的堆积模型为__________,D的醋酸盐晶体局部结构如图三,该晶体中含有的化学键是__________ (填选项序号)。
①极性键 ②非极性键 ③配位键 ④金属键
(5)向D的硫酸盐溶液中滴加过量氨水,观察到的现象是______________________________。
请写出上述过程的离子方程式:___________________________,__________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】测定CuSO4·xH2O晶体的x值,有关质量数据如表中所示,已知x的理论值为5.0,产生误差的可能原因是( )

A.晶体中含不挥发杂质B.加热时蓝色未完全变白
C.没有放在干燥器中冷却D.加热时有晶体溅出
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用NA表示阿伏加德罗常数,下列说法正确的是( )
A.50mL 18.4mol/L浓硫酸与足量铜微热反应,生成SO2分子数目为0.46NA
B.2.3gNa与氧气完全反应,反应中转移的电子数介于0.1NA到0.2NA之间
C.用惰性电极电解饱和食盐水,若线路中通过NA 个电子,则阴极产生11.2L (标况)气体
D.已知N2(g)+3H2(g) ![]() 2NH3(g) ΔH=-92kJ·mol-1,现有0.1molN2与0.3molH2混合反应,可放热9.2kJ
2NH3(g) ΔH=-92kJ·mol-1,现有0.1molN2与0.3molH2混合反应,可放热9.2kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由短周期元素组成的中学常见的含钠元素的物质A、B、C、D,存在如图转化关系(部分生成物和反应条件已略去)。

(1)若A为过氧化钠,A与CO2反应的化学方程式为___,A与水反应的离子方程式为___。
(2)①向饱和C溶液中通CO2,化学方程式为:___。
②1mol/L的B溶液逐滴加入1L1mol/L的AlCl3溶液中,产生白色沉淀39g,则所加入的B溶液的体积可能为___L。
(3)下列图象中,横坐标表示加入试剂或通入气体的物质的量,纵坐标表示产生沉淀的质量,用图象的序号或文字回答下列问题:

Ⅰ.表示向AlCl3溶液中逐渐滴加NaOH溶液的是___;
Ⅱ.表示向NaAlO2溶液中逐渐滴加稀盐酸的是___;
Ⅲ.表示向NaAlO2溶液中通入CO2的是___;
Ⅳ.③图___(填“能”或“不能”)代表向含NaOH的澄清石灰水中通入CO2。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com